Podobno cydr nigdy tak na prawdę nie traci kontaktu z jabłonią, a zachodzące w nim przemiany podążają nieprzerwanie w harmonii z rytmem przyrody. I tak, gdy na wiosnę w sadzie rozkwitają jabłonie – w spiżarniach, piwnicach i na strychach zakwita również cydr.
Coś w tym jest, bo moje cydry, które tak pracowicie przygotowywałem cały poprzedni sezon, porzuciły drożdżowe nuty, dojrzały, i smakują już niczego sobie. Mogę zdradzić, że – zgodnie z oczekiwaniami – różnorodność jest ogromna! Szczegóły wkrótce 🙂
Tymczasem, jeszcze na chwilę wracam do tematu dwutlenku siarki, a konkretnie do tego w jaki sposób można zmierzyć zawartość SO2.
Jak pisałem wcześniej, dwutlenek siarki towarzyszy wyrobowi napojów fermentowanych od niepamiętnych czasów. Jak można się domyślać, również od dawna znane są sposoby pomiaru jego zawartości. Najstarsza metoda, tzw. miareczkowanie Ripper’a, liczy sobie już ponad 100 lat, i – pomimo że istnieją obecnie bardziej nowoczesne, obarczone mniejszym błędem metody – wciąż pozostaje w powszechnym użyciu, ze względu na prostotę, niewielkie koszty oraz dostępność sprzętu i odczynników.
Metoda Ripper’a opiera się na następującej reakcji:
SO2 + 2H2O + I2 -> H2SO4 + 2HI
Do odmierzonej próbki stopniowo dodaje się jod, który wchodzi w reakcję z SO2. Jod dodaje się tak długo aż skończy się SO2 i w próbce pojawi się niezwiązany jod. Ilość SO2 wyznacza się na podstawie tego ile jodu trzeba było w sumie dodać. Jako wskaźnika, że zapas SO2 uległ wyczerpaniu i w próbce pojawił się wolny jod, używa się skrobi, która w obecności jodu zmienia kolor.
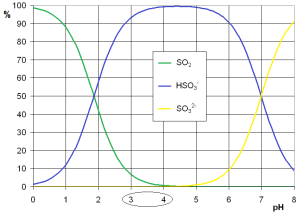
To nie koniec. Jak pamiętamy, dwutlenek siarki występuje w trzech formach:
Rysunek 1 – Formy dwutlenku siarki w zależności od pH roztworu
Udział cząsteczek SO2 w próbce o pH typowym dla cydru (3-4) waha się na poziomie kilku procent i nie wiemy jaki jest dokładnie. Żeby powyższa reakcja miała sens i żeby dało się z niej coś wywnioskować, trzeba przekształcić cały dwutlenek siarki do postaci cząsteczek SO2: tym celu do próbki dodaje się kwas siarkowy w takiej ilości, aby obniżyć pH do poziomu bliskiego 0.
W podstawowej wersji, rezultat otrzymany za pomocą metody Ripper’a mówi nam ile w próbce jest wolnego SO2. Bo jak pamiętamy, SO2 występuje w formie wolnej i związanej:
Rysunek 2 – Podział SO2 na związane i wolne (bez zachowania proporcji!)
Związane SO2 nie wchodzi w reakcje z jodem. Żeby oszacować całkowitą zawartość SO2 w próbce, trzeba uprzednio uwolnić związane SO2. W tym celu do próbki dodaje się zasadę (NaOH) – celem jest podniesienie pH powyżej pH 12, bo wtedy puszczają wiązania. Dopiero potem dodaje się kwas i miareczkuje jodem.
Odczynniki
W metodzie Ripper’a potrzebne są następujące odczynniki.
Pomiar wolnego SO2:
- roztwór jodu
- kwas siarkowy
- wskaźnik skrobiowy
Pomiar całkowitego SO2, dodatkowo:
- wodorotlenek sodu, NaOH
Opcjonalnie, patrz Dokładność i modyfikacje:
- wodorowęglan sodu
- woda utleniona
Roztwór jodu musi być mianowany, to znaczy musimy znać ilość moli (M) w jednostce objętości, bo to jest podstawa do obliczeń. Zwykle stosuje się roztwory 0,01M lub 0,01N – trzeba pamiętać że w przypadku jodu to nie to samo: 0,01M = 0,02N. Roztwory jodu są dostępne w sklepach dla winiarzy, często od razu w zestawie z innymi odczynnikami do pomiaru SO2.
Kwas siarkowy nie musi mieć dokładnego stężenia. W większości przypadków zalecane jest użycie roztworu ~25%, który można wykonać samemu rozcieńczając stężony kwas w proporcji 1 do 3 z wodą. Pamiętamy, że kwas jest niebezpieczny, że wlewamy zawsze kwas do wody, i że przy okazji wydziela się dość dużo ciepła.
W przypadku wodorotlenku sodu wygodnie jest operować roztworem rzędu 1M, który można przygotować samodzielnie rozpuszczając 40g sproszkowanego NaOH (dostępny np. na Allegro) w około 800ml destylowanej wody. Również w tym przypadku dokładność nie jest istotna.
Wskaźnik skrobiowy, podobnie jak roztwór jodu, można kupić w sklepach z akcesoriami dla winiarzy. Alternatywnie można posłużyć się skrobią rozpuszczalną (np. Allegro): 2,5g skrobi gotujemy w 100ml wody, następnie studzimy.
Zdjęcie 1 – Zestaw do pomiaru SO2
Procedura
Mając już odczynniki, samo przeprowadzenie pomiaru SO2 metodą Ripper’a to nic skomplikowanego.
Pomiar wolnego SO2
- do naczynia o pojemności np. 100ml wlewamy 25ml cydru
- dodajemy 1ml roztworu skrobi
- dodajemy 5ml kwasu siarkowego (25%)
- stopniowo dodajemy roztwór jodu, mieszając, aż do momentu jak próbka zmieni kolor na niebieski i barwa utrzyma się przez 30 sekund
Miareczkowanie trzeba przeprowadzać natychmiast po dodaniu kwasu i robić to sprawnie: cząsteczki SO2 to nic innego jak cząsteczki gazu, które uciekają z próbki oraz chętnie wchodzą w reakcję z tlenem.
Pomiar całkowitego SO2
- do naczynia o pojemności np. 100ml wlewamy 25ml cydru
- dodajemy 25ml wodorotlenku sodu (1M)
- czekamy 10 minut
- dodajemy 1ml roztworu skrobi
- dodajemy 10ml kwasu siarkowego (25%)
- stopniowo dodajemy roztwór jodu, mieszając, aż do momentu jak próbka zmieni kolor na niebieski i barwa utrzyma się przez 30 sekund
Zdjęcie 2 – Końcowe zabarwienie próbki
Obliczenia
Pozostaje już tylko przeliczyć wyznaczoną podczas pomiaru objętość roztworu jodu na interesującą nas zawartość SO2.
Z równania reakcji wynika, że jeden mol jodu wiąże jeden mol SO2. Wiemy jaką objętość roztworu jodu musieliśmy dodać, znamy stężenie molowe – wiemy więc ile moli jodu dodaliśmy, a co za tym idzie ile moli SO2 znajdowało się w próbce. Wiedząc że masa mola SO2 wynosi 64g, wiemy ile gramów SO2 się w niej znajdowało. Pozostaje już tyle przeskalować objętość próbki do jednego litra.
SO2 [mg/L] = objętość roztworu jodu [ml] * stężenie molowe (M) roztworu jodu * 64 * 1000 / objętość próbki [ml]
Zakładając, że mamy roztwór jodu o stężeniu 0,01N (czyli 0,005M), a nasza próbka ma objętość 25ml: SO2 [mg/L] = objętość roztworu jodu [ml] * 12,8.
Dokładność i modyfikacje
Metoda Ripper’a nie jest bardzo dokładna – szacuje się, że błąd pomiaru wynosi ~10%. Powodów jest kilka.
Przede wszystkim, w wyniku obniżenia pH, niektóre związane formy SO2 ulegają rozpadowi, co przekłada się na to, że wyniki pomiaru wolnego SO2 są zwykle nieco zawyżone.
Innym czynnikiem wpływającym na zawyżenie wyników jest sam jod, a konkretnie jego skłonność do reagowania nie tylko z samym SO2, ale również z niektórymi innymi składnikami próbki, np. z fenolami. W rezultacie, wynik dla próbek, które są bogate np. w taniny będzie nieco zawyżony.
O ile w pierwszym przypadku trzeba po prostu pogodzić się z niedokładnością, o tyle w drugim można pokusić się o wyznaczenie poprawki. Żeby ustalić ilość jodu, która weszła w reakcję z innymi niż SO2 składnikami, trzeba wykonać drugi pomiar, usuwając uprzednio z próbki całe SO2. Najprostszym sposobem na usunięcie SO2 jest dodanie do próbki nadtlenku wodoru (H2O2) w postaci wody utlenionej. Jeden ml wody utlenionej ma zdolność redukcji zawartości SO2 o ~60ppm/litr, więc do próbki wystarczy dodać dosłownie kilka kropel. Poprawkę odejmuje się od wyniku pomiaru właściwego.
Warto mieć też na uwadze, że roztwór jodu nie jest stabilny i z czasem jego stężenie maleje, co również przekłada się na wyniki odbiegające in-plus od rzeczywistości. Można pokusić się o samodzielną standaryzację (wyznaczanie stężenia) roztworu jodu, ale w tym celu trzeba mieć z kolei mianowany roztwór tiosiarczanu sodu (Na2S2O3)… O ile procedura takiej standaryzacji jest banalnie prosta, o tyle nie wiem gdzie taki roztwór zdobyć. Można by go w sumie samemu wykonać, używając w tym celu kolejnych odczynników… ale może nie zakładajmy od razu laboratorium 🙂
Mimo wszystko nie można zakładać, że wynik zawsze będzie nieco zawyżony. Jak wspominałem, SO2 jest gazem i trzeba się liczyć z tym że jego zawartość w próbce, szczególnie po dodaniu kwasu gdy cały dwutlenek siarki przybiera formę cząsteczek gazu, będzie dość szybko maleć: im dłużej będziemy zwlekać, tym pomiar wykaże mniejszą zawartość SO2. Można temu przeciwdziałać dodając do próbki, tuż przed aplikacją kwasu, odrobinę (tzn. ~0,5g) wodorowęglanu sodu, NaHCO3 – w efekcie z próbki zacznie wydzielać się dwutlenek węgla, który uformuje na powierzchni próbki ochronną warstwę, zapobiegającą utlenianiu się SO2.
Przykładowe pomiary
Zrobiłem kilka prób na niedawno zabutelkowanych cydrach. Pomiar wolnego SO2 nie przyniósł żadnych zaskoczeń: poziom praktycznie zerowy. Również całkowita zawartość SO2 wygląda rozsądnie: rzędu 120ppm, czyli z grubsza tyle ile faktycznie aplikowałem przed fermentacją.
Bardzo ciekawił mnie wynik całkowitej zawartości SO2 w próbce Boskoop’a. Z Boskoop’em była taka historia, że chciałem przetestować fermentację na dzikich drożdżach, w niskej temperaturze. W tym celu nalałem sok do jednego z tych cudownych słoi, o których kiedyś wspominałem:
Zdjęcie 3 – Podstępny słój
Słój był napełniony w 3/4 objętości – miałem w planie po zakończonej fermentacji przelać zawartość do 5L damy. Nakręciłem nasadkę, która ma tutaj pełnić rolę rurki fermentacyjnej, zalałem 2% roztworem pirosiarczynu sodu, z racji tego że ten płyn jest narażony na bezpośredni kontakt z otoczeniem, po czym wystawiłem na zewnątrz, gdzie temperatura wynosiła zaledwie kilka stopni.
Kilkanaście minut później zauważyłem, że na nakrętce nie ma żadnego płynu – pomyślałem, że zapomniałem, dolałem… kilkanaście minut później płynu ponownie nie było…
Okazało się, że słój jest tak genialnie skonstruowany, że kurczące się pod wpływem chłodu powietrze zasysa do środka płyn jakim jest zalany kapturek.
Efekt? Pomiar wolnego SO2 nie wykazał nic podejrzanego. Za to pomiar całkowitej zawartości wykazał prawie 300ppm! Zgadza się to, niestety, z tym co sobie wcześniej szacowałem.