O tym jak ważnym składnikiem jest azot pisałem szczegółowo w poprzednim wpisie. Nie tylko pobudza mikroorganizmy do życia, ale także w istotny sposób wpływa zarówno na przebieg procesów towarzyszących powstawaniu cydru, jak i na efekt końcowy.
Pytanie zasadnicze brzmi: czy zawartość azotu da się jakoś zmierzyć?
Odpowiedź jest nieco wymijająca: owszem, zawartość azotu można do pewnego stopnia oszacować 🙂
Zawartość azotu w jabłkach, a co za tym idzie w soku jabłkowym, jest bardzo różna i zależy od wielu czynników, m.in. technik sadowniczych (w tym oczywiście nawożenia), rodzaju stosowanych podkładek, wieku drzew, stanowiska, pogody w danym sezonie, stopnia dojrzałości etc. Typowa ilość azotu w soku jabłkowym waha się w granicach 50-300 mg/l, choć zdarzają się skrajne przypadki gdzie azotu jest ledwie 10 mg/l, lub wręcz 600 mg/l. Dolną granicą przy której fermentacja ma szanse zakończyć się sukcesem jest 50 mg/l; 75-100mg/l to takie bezpieczne optimum; podczas gdy powyżej 120 mg/l mówimy o nadmiarze azotu. Nadmiar azotu jest dla cydru niekorzystny.
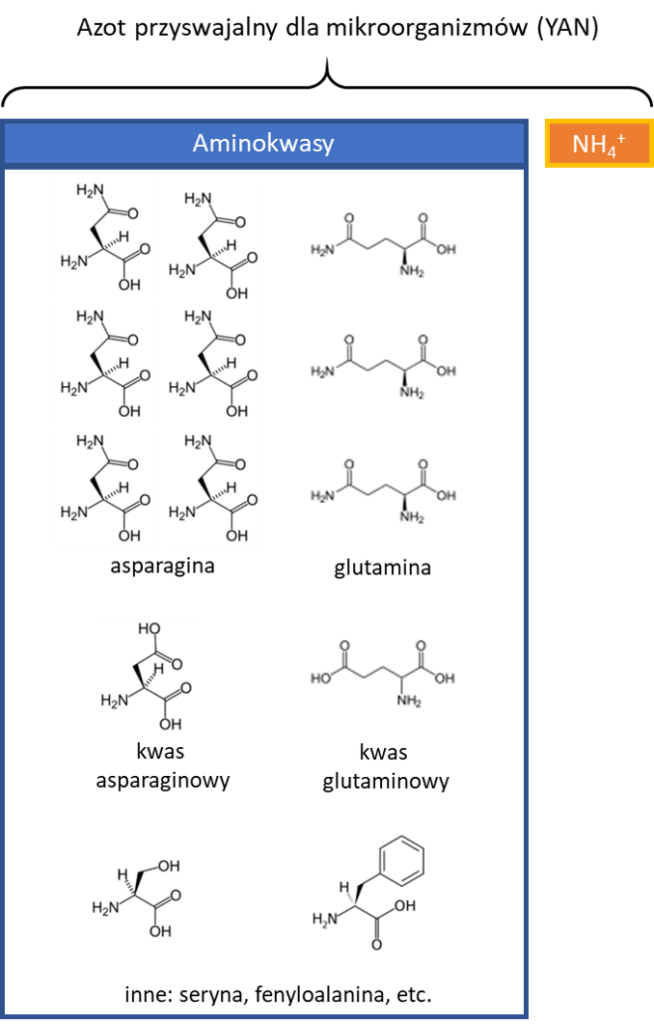
Azot w soku jabłkowym znajduje się w aminokwasach, jonach amonowych NH4+, krótkich polipeptydach oraz proteinach, czyli białkach. Mikroorganizmy korzystają z dwóch pierwszych źródeł – jest to tak zwany azot przyswajalny: YAN – yeast assimilable nitrogen, (angielska nazwa jest nieco myląca, bo korzystają z niego oczywiście wszystkie mikroorganizmy, nie tylko drożdże). Azot zawarty w polipeptydach i białkach jest dla mikroorganizmów niedostępny; tak czy siak tych związków w soku jabłkowym jest stosunkowo niewiele.
W soku jabłkowym, YAN składa się w 90% z aminokwasów i 10% z jonów NH4+. Aminokwasy to związki organiczne, w przeciwieństwie do jonów amonowych – stąd też mówi się o azocie organicznym i nieorganicznym. Drożdże (jak również większość mikroorganizmów) preferują jony NH4+ i, jeśli tylko są dostępne, to właśnie z nich będą pobierać azot. Aminokwasy mają nieco bardziej skomplikowaną budowę: azot uwięziony jest w formie grupy aminowej -NH2 (jednej lub kilku), która jest elementem większej struktury – żeby się do niego dostać, mikroorganizmy muszą aminokwas rozmontować. Stopień trudności takiego demontażu zależy od konkretnego aminokwasu, więc mikroorganizmy nie ze wszystkich korzystają równie chętnie. Z niektórych nie skorzystają w ogóle, chociaż takich w soku jabłkowym jest bardzo niewiele. Spośród ~20 podstawowych aminokwasów, w soku jabłkowym dominuje asparagina i glutamina, które wraz z kwasem asparaginowym i kwas glutaminowym stanowią ponad 80% całości. Azot zawarty w tych aminokwasach jest dla mikroorganizmów stosunkowo łatwo dostępny.
Wszystko to są oczywiście wartości średnie, odnoszące się do typowego, statystycznego soku. Zarówno proporcje pomiędzy azotem organicznym i nieorganicznym, jak i zawartość poszczególnych aminokwasów, podlegają znacznym naturalnym wahaniom.
Czyli podsumowując:
Dokładny pomiar zawartości azotu wymaga specjalistycznego sprzętu i odczynników (spektrografia) lub trudnych do osiągnięcia warunków (metoda Kjeldahla), jak również dużego doświadczenia – przez co nie jest możliwy do przeprowadzenia w amatorskich warunkach. Jedynym sposobem, który pozostaje w zasięgu hobbysty/amatora jest metoda formolowa. W przypadku soku jabłkowego, metoda ta obarczona jest stosunkowo dużym błędem, choć do pewnego stopnia można go skorygować.
Metoda formolowa
Podstawą metody formolowej jest reakcja formaliny ze związkami zawierającymi azot. W wyniku tej reakcji, każda cząsteczka aminokwasu, lub jonu NH4+, uwalnia kation wodoru, przez co obniża się pH roztworu. Na podstawie analizy pH można określić liczbę tych cząsteczek, a co za tym idzie oszacować zawartość azotu. Zawartość azotu nie jest tutaj mierzona bezpośrednio, tylko wyliczana z ogólnej ilości cząsteczek aminokwasów oraz jonów amonowych, zakładając że każda taka cząsteczka dostarcza 1 N.
Metoda ta sprawdza się bardzo dobrze w przypadku wina, ponieważ w soku z winogron na jedną cząsteczkę aminokwasu przypada średnio ~1 azot. Niestety, w przypadku soku jabłkowego, dominującymi aminokwasami są asparagina i glutamina, z których każdy zawiera po dwa atomy N. Te dwa aminokwasy stanowią rzędu 50-70% wszystkich. W związku z tym, na jedną cząsteczkę związku zawierającego azot (aminokwasy i jony razem wzięte), w soku jabłkowym przypada statystycznie około 1,5 atomu azotu. Przez to, żeby dostać wartość bardziej odpowiadającą rzeczywistości, otrzymany za pomocą klasycznej metody formolowej wynik trzeba pomnożyć przez ~1,5. Choć tak na prawdę każdy sok może wymagać innej poprawki, ze względu na konkretny skład aminokwasów – dlatego też, w przypadku soku jabłkowego, metoda formolowa daje wynik jedynie orientacyjny.
Procedura
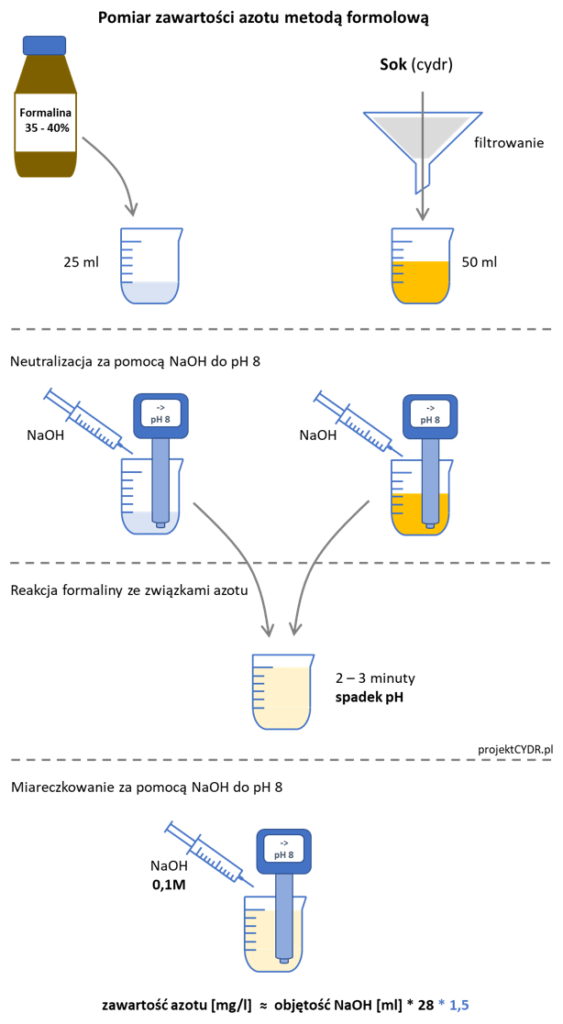
Krok 1:
Do jednej zlewki (np. 100ml) wlać 25ml formaliny.
Do drugiej zlewki przefiltrować 50ml badanego soku (lub cydru).
Formalina jest bardzo nieprzyjemną substancją, o bardzo szkodliwym działaniu, więc trzeba się z nią obchodzić ostrożnie, żeby się nie poparzyć i nie uszkodzić oczu. Szkodliwe są również jej opary, więc nie należy się nad nią nachylać. Wskazana jest dobra wentylacja.
Dokładna objętość formaliny nie jest krytyczna, jej ilość przewidziana jest z dużym zapasem, wystarczającym do pomiaru zawartości azotu do rzędu kilku tysięcy miligramów na litr – kilka mililitrów w te czy we wte nie robi żadnej różnicy. Natomiast sok trzeba odmierzyć dokładnie, ponieważ od jego objętości zależy wynik.
Filtrowanie jest istotne, ponieważ pozwala zredukować ilość „zanieczyszczeń”, które mogłyby wejść w reakcję z formaliną i przez to wpłynąć na wynik. Sok powinien być możliwie jak najbardziej przezroczysty. Do filtrowania można użyć np, filtra od kawy, lub torebki do zaparzania herbaty, umieszczonych w lejku. Filtrowanie może potrwać dobrą chwilę.
Krok 2:
Obie zlewki trzeba zneutralizować do tego samego pH, za pomocą NaOH. Zwykle neutralizuje się do pH 8, chociaż może to być równie dobrze 7 czy 9 – ważne żeby zawsze była to taka sama wartość.
Profesjonalnie, neutralizację przeprowadza się w ten sposób, że najpierw dodaje się NaOH 1M, a gdy pH zaczyna zbliżać się do pożądanej granicy, zmienia się na 10-krotnie słabsze: 0.1M. W ten sposób zużywa się mniej odczynników, wzrost objętości jest mniejszy, podczas gdy sama końcówka dochodzenia do założonej wartości pH wciąż jest przeprowadzana z dużą dokładnością. Oczywiście na wstępie nie wiadomo dokładnie ile takiego mocniejszego NaOH trzeba dodać, więc za pierwszym razem przeprowadza się taką operację na szybko, żeby z grubsza ustalić wymagane ilości.
Czysta formalina ma pH rzędu 3-3.5 i neutralizacja 25ml wymaga dodania stosunkowo niewielkiej ilości, bo około 0,2-0,3ml NaOH 1M. Sok jabłkowy może mieć pH w zakresie 3-4 i do neutralizacji 50ml potrzeba od rzędu 2-3 do nawet 10 mililitrów NaOH 1M, co zależy bezpośrednio od kwasowości całkowitej. Ilość NaOH dodawanego na tym etapie nie jest istotna – nie trzeba jej ani dokładnie odmierzać (można posłużyć się dowolną strzykawką) ani zapisywać. Nie jest również istotne, żeby posługiwać się dokładnymi stężeniami molowymi. Liczy się jedynie efekt końcowy, czyli osiągnięcie docelowego pH.
Do określenia końcowego pH konieczne jest posłużenie się miernikiem pH. Papierki wskaźnikowe w ogóle się do tego celu nie nadają. Ewentualnie, zamiast pH-metru, można posłużyć się fenoloftaleiną (kilka kropel), która zaczyna zmieniać kolor w okolicy pH 8.2 – ale jeśli ktoś nie ma w tym na prawdę dużej wprawy, nie ma co liczyć na dużą dokładność, bo bardzo trudno jest złapać odpowiedni moment, i do tego taki sam w obydwu próbkach. Bardzo istotne, żeby obie próbki miały dokładnie takie samo pH.
Jeśli planujemy przeprowadzenie większej liczby pomiarów, można za jednym zamachem przygotować większą ilość zneutralizowanej formaliny, ale ponieważ zneutralizowana formalina nie jest stabilna i jej pH dość szybko zaczyna ponownie spadać, przed każdym użyciem trzeba dokonać jej sprawdzenia i ewentualnej korekty.
Krok 3
Następnie, obie zneutralizowane próbki miesza się ze sobą i pozostawia na kilka minut.
W rezultacie zachodzącej reakcji następuje spadek odczynu pH.
Krok 4
Pomiar właściwy. Teraz chcemy się dowiedzieć ile konkretnie, w wyniku powyższej reakcji, uwolniło się kationów wodoru, a co za tym idzie ile w naszej próbce było cząsteczek zawierających azot. W tym celu, ponownie miareczkujemy roztwór, dodając NaOH 0.1M, aż do osiągnięcia takiego samego pH jak w kroku 2. Wartością szukaną jest objętość NaOH, potrzebna do ponownej neutralizacji.
Na tym etapie ważne jest żeby NaOH odmierzać dokładnie, ponieważ będą to pojedyncze mililitry. Najlepiej posłużyć się przy tym biuretą, lub ewentualnie małą strzykawką, ze skalą w dziesiątych częściach mililitra. Ważne również żeby stosować roztwór o znanym stężeniu: tutaj 0.1M. Najlepiej kupić gotowy roztwór, przeznaczony do celów analitycznych (ja zamawiam na marxam.pl), ewentualnie można przygotować go samodzielnie rozpuszczając 4g granulek NaOH w 1l destylowanej wody.
Znając objętość NaOH 0.1M potrzebną do przywrócenia pH do poprzedniego poziomu, zawartość azotu wylicza się ze wzoru:
zawartość azotu [mg/l] ≈ objętość NaOH 0.1M [ml] * 28 * 1.5
Gdzie współczynnik 1.5 to wspomniana powyżej poprawka dla soku jabłkowego. Czyli 1 ml NaOH przekłada się na zawartość 42 mg/l azotu (mniej więcej).
W celu zwiększenia dokładności można użyć NaOH o np. dwukrotnie mniejszym stężeniu: 0.05M (czyli rozcieńczyć 1:1 wodą destylowaną) – dzięki temu 1ml będzie odpowiadał 21 mg/l. Można też dwukrotnie zwiększyć ilość soku poddawanego analizie (a co za tym idzie również ilość formaliny), co również przełoży się na dwukrotnie zwiększoną dokładność.
Próbny pomiar
W celu upewnienia się że dobrze wykonujemy pomiar, można przeprowadzić próbę z wykorzystaniem zwykłej nieorganicznej pożywki, zawierającej czysty fosforan amonu, czyli DAP. Po rozpuszczeniu 1g takiej pożywki w 1l wody otrzymujemy roztwór o zawartości około 210 mg/l azotu. A ponieważ DAP dostarcza wyłącznie jonów NH4+, zmierzona w kroku 4 objętość NaOH powinna oscylować w okolicach 210 / 28 = 7,5 ml.
Ile azotu jest w jabłkach
Cały temat azotu wziął się stąd, że chciałem się przekonać ile prawdy jest w „przenawożeniu” jabłek ze sklepów i czy faktycznie są jakieś wyraźne różnice w porównaniu z jabłkami nienawożonych sadów.
Pomiar zawartości azotu w soku w jabłkach z mojego ogródka (gdzie owszem trochę nawozu idzie na trawnik, ale poza tym drzewek nie dokarmiam w żaden sposób – ogólnie wszystko rośnie bardzo ładnie, więc najwyraźniej ziemia jest żyzna) wyniósł 1,8ml NaOH, czyli ~75mg/l. Czyli idealnie 🙂
Za to zawartość azotu w dwóch testowych nastawach na bazie jabłek kupionych na Rybitwach (miksy różnych gatunków, od dwóch rożnych dostawców), w obydwu przypadkach okazała się ponad dwukrotnie wyższa: 4,3ml i 4,5 ml – co przekłada się na około 180-190mg/l !
Czyli, jak widać, różnica jest i to znacząca, zaś azotu w komercyjnych jabłkach jest zdecydowanie, jak na potrzeby cydru, za dużo!

Jakby Ci się chciało to opcje klarowania jakie są stosowane to – pekto, pekto + bentonit, pekto plus zol i żelatyna, kombo wszystkiego i dla porównania keeving i czysty sok. Ja nie mam takiego zacięcia badawczego 😉 ewentualnie jeszcze porównanie z sokiem klarowanym z kartonu – tam jest stosowane „kombo”. Chętnie bym takie porównanie zobaczył.
Nie klarowałem tych soków, tylko filtrowałem przez papierowy filterek, żeby pozbyć się grubych zanieczyszczeń. Nie były klarowne. Porównania zrobię z ciekawości w przyszłym sezonie, przy okazji.
Tak, zarówno wstępne oczyszczanie soku za pomocą pekto, jak i późniejsze klarowanie (czy to środkami klarującymi czy poprzez keeving) powoduje zmniejszenie zawartości N. Keeving z tego zdaje się być najskuteczniejszy – redukcja rzędu 50%.
Czy robiłeś pomiar na soku bezpośrednio wyciśniętym, czy na klarowanym? A może porównywałeś? Z relacji winiarzy wynika, ze sok po solidnym sklarowaniu ma b. mało yan i roboczo im wyższa klarowność tym mniej yan w moszczu.