Czas podsumować czego udało mi się do tej pory dowiedzieć o kwasie. Trochę zleciało od ostatniego razu, ale zależało mi żeby zweryfikować teorię w praktyce i pokazać co nieco – a to wymagało zorganizowania kilku pomocy naukowych i odczynników.
Kwas jest wymieniany jednym tchem, zaraz po cukrze i tuż przed garbnikami, jako jeden z trzech najważniejszych składników soku jabłkowego. Jego zawartość, mierzona w gramach na litr, ma bezpośredni wpływ na smak, zaś wyrażona jako odczyn pH, wpływa m.in. na pracę drożdży, czy na rozwój różnych cydrowych choróbsk.
Teraz będzie o gramach na litr, a o pH pogadamy następnym razem.
No to jak ten kwas wpływa na smak? Bez odpowiedniej ilości kwasu smak jest mdły, a jak jest go przesadnie dużo, to wiadomo, trochę wykrzywia (ja tam akurat lubię jak jest kwaśno, ale chyba należę do mniejszości). Gdy kwasu jest w sam raz, pijąc mamy przyjemne poczucie świeżości.
Jest tu pewna pułapka. Liczy się nie tyle sama zawartość kwasu, ale proporcje. Im sok (czy też cydr) jest słodszy, tym więcej powinien mieć kwasu żeby dać takie same wrażenie smakowe jakie dałby odpowiednik o mniejszej zawartości cukru. Podobnie, choć w mniejszym stopniu, na percepcję kwaśnego smaku wpływa zawartość alkoholu. Z kolei przy dużej zawartości tanin, która dodaje goryczy i/lub cierpkości, kwasu powinno być mniej.
Co z tego wynika? Z soku, który przed fermentacją jest smaczny i ma idealne proporcje – po fermentacji, gdy cały cukier zmieni się w alkohol, wyjdzie cydr sporo kwaśniejszy.
Według niektórych źródeł, sok na cydr powinien być przede wszystkim słodki, z lekko wyczuwalnym kwaśnym smakiem. Inni piszą że najlepszy cydr wychodzi z soku, który nie jest smaczny do picia 😉
Jeśli pojawiają się konkretne zalecenia odnośnie zawartości kwasu to jest to zwykle 4g-6g kwasu na litr w przypadku soku o dużej zawartości tanin, i 6g-7,5g gdy tanin jest mało. Z tym że to dla cydrów docelowo wytrawnych – w cydrach słodszych kwasu może być więcej. I tego zamierzam się trzymać dopóki doświadczenie nie nauczy mnie inaczej 🙂
Pojawiły się gramy na litr – tak właśnie mierzy i wyraża się zawartość kwasu w soku, jeśli interesuje nas jego wpływ na smak. Oczywiście ma to swoje przełożenie na pH roztworu – im więcej kwasu tym pH będzie niższe itd. – ale nie ma bezpośredniej zależności między pH a zawartością kwasów wyrażoną w g/L – nie można zmierzyć pH i na tej podstawie stwierdzić że kwasu jest konkretnie tyle a tyle, i vice-versa: na podstawie znajomości zawartości kwasu w g/L nie da się określić pH.
O jakim konkretnie kwasie mówimy? Ze wszystkich kwasów zawartych w soku jabłkowym zdecydowaną większość (~90%) stanowi oczywiście kwas jabłkowy. Wśród pozostałych kwasów są m.in. kwas cytrynowy, chinowy, mlekowy. Tak samo jak w przypadku innych substancji w soku, dokładna zawartość kwasów oraz ich wzajemne proporcje zależą od wielu czynników. Wiadomo oczywiście, że w zależności od gatunku jabłek zawartość kwasu w soku będzie ogólnie mniejsza bądź większa – ale konkretną zawartość trzeba za każdym razem zmierzyć. Dodatkowo zarówno całkowita zawartość, jak i proporcje pomiędzy poszczególnymi kwasami, ulegają zmianie w procesie fermentacji: niektóre szczepy drożdży, np. Lalvin 71B, powodują znaczne zmniejszenie zawartości kwasów (o czym miałem okazję niedawno się przekonać), zaś jeśli dojdzie do fermentacji jabłkowo-mlekowej, którą z kolei zawdzięczamy działaniu bakterii, kwas jabłkowy zostanie przetworzony na kwas mlekowy. Także zawartość kwasu w cydrze może znacząco różnić się od tego co zmierzyliśmy w początkowym soku jabłkowym.
Sama procedura pomiaru zawartości kwasu jest bardzo prosta. Polega na stopniowym dodawaniu do soku zasady, aż do momentu jak wszystkie cząsteczki kwasu zostaną zneutralizowane.
Jako zasadę zwykle używa się roztworu wodorotlenku sodu, NaOH, o znanym stężeniu molowym, zwykle 0,1 mol/L – do kupienia w sklepach z akcesoriami do robienia wina bądź piwa.
Reakcja chemiczna, którą przeprowadzamy oznaczając kwasowość w soku jabłkowym wygląda tak:
C4H6O5 + 2NaOH -> Na2C4H4O5 + 2H2O
Do zneutralizowania jednej cząsteczki kwasu jabłkowego (to właśnie jest C4H6O5) potrzeba dwóch cząsteczek zasady – w efekcie powstaje cząsteczka soli i dwie cząsteczki wody.
Reakcje dla innych kwasów wyglądają w większości tak samo – zmieniają się tylko proporcje pierwiastków w powstającej soli. Przykładowo: kwas cytrynowy ma wzór C6H8O7, a kwas winowy to C4H6O6.
Obliczenia nie są skomplikowane. Znamy objętość próbki soku (Vsoku) oraz stężenie molowe zasady którą używamy (Nzasady). Do tego znamy eksperymentalnie wyznaczoną objętość zasady (Vzasady), którą musieliśmy dodać żeby zneutralizować wszystkie cząsteczki kwasu.
Znając objętość zasady, wiemy że w celu zneutralizowania wszystkich cząsteczek kwasu w próbce potrzebowaliśmy dodać Vzasady * Nzasady, czyli cząsteczek kwasu w próbce było o połowę mniej:
Lcząsteczek kwasu w próbce soku = ½* Vzasady [L] * Nzasady [mol/L]
Wiedząc ile cząsteczek jest w próbce soku, możemy policzyć ile ich jest w litrze:
Lcząsteczek kwasu w litrze soku = Lcząsteczek kwasu w próbce soku * 1L / Vsoku [L] =
= ½ * Vzasady [L] * Nzasady [mol/L] * 1L / Vsoku [L] =
= ½ * Vzasady * Nzasady / Vsoku [mol]
No, to wiemy ile moli cząsteczek kwasu jest w litrze, wiemy z jakich pierwiastków składają się cząsteczki poszczególnych kwasów, a z tablicy Mendelejewa wiemy ile te pierwiastki ważą – więc zdaje się że możemy wyliczyć masę tych cząsteczek w litrze, ale… nie wiemy przecież jakie konkretnie kwasy zneutralizowaliśmy, a przecież cząsteczka każdego kwasu ma inną masę.
I tutaj robimy pewne uproszczenie: zakładamy że w soku jest 100% kwasu jabłkowego, i że wszystkie zneutralizowane przez nas cząsteczki to C4H6O5. To jest pewne przybliżenie i trzeba mieć na względzie że dokładność takiego pomiaru jest „orientacyjna”, czyli pozwala nam się jedynie zorientować ile mniej więcej tych kwasów jest – nie można takiego wyniku traktować dosłownie 🙂
Masa cząsteczkowa kwasu jabłkowego wynosi 4 * 12 + 6 *1 + 5 * 16 = 134, czyli mol tego kwasu waży 134 gramy. Stąd masa kwasu w litrze soku wynosi:
mkwasu = 134 [g/mol] * ½ * Vzasady * Nzasady / Vsoku =
= 67 * Vzasady / Vsoku * Nzasady [g]
Podstawiając typowo używane wartości: próbka 10ml, stężenie molowe zasady 0,1, dostajemy:
mkwasu = 0,67 * Vzasady
Na marginesie: w przypadku pomiaru kwasowości wina, gdzie zakłada się że całym kwasem jest kwas winowy, zamiast współczynnika 0,67 używa się 0,75, ponieważ masa mola tego kwasu (C4H6O6) wynosi 150 g.
Teraz pozostaje jedynie wyznaczenie objętości zasady. Nareszcie trochę zabawy! 🙂
Zasadnicze pytanie na jakie trzeba sobie odpowiedzieć to: skąd właściwie wiadomo kiedy wszystkie cząsteczki kwasu zostały zneutralizowane?
Pierwsze co przychodzi do głowy to sprawdzenie pH roztworu – na chłopski rozum powinno być neutralne, czyli 7. Dodatkowo zdaje się to być potwierdzone przez to że do określenia momentu kiedy roztwór osiągnie wymagane pH jako wskaźnika powszechnie używa się błękitu bromotymolowego, BBT, który zmienia barwę z żółto/pomarańczowej na niebieską w okolicach właśnie pH = 7. I już byłem gotowy odtrąbić sukces, ale zwróciłem uwagę że niektóre źródła zamiast, lub oprócz, błękitnego płynu, polecają użycie fenoloftaleiny – a ta zaczyna zmieniać zabarwienie gdy pH roztworu osiąga ~8,3. A wzory i współczynniki są takie same, niezależnie od użytego wskaźnika. No ale jak to tak?
NaOH jest mocną zasadą, a kwas jabłkowy, jako kwas organiczny, jest kwasem słabym. Sól, która powstaje w wyniku reakcji słabego kwasu z mocną zasadą ma odczyn zasadowy. Po zneutralizowaniu wszystkich cząsteczek kwasu, końcowy odczyn roztworu jest >7, z tym że nie można dokładnie określić końcowej wartości, ponieważ im więcej kwasu było w próbce, tym więcej powstanie soli i tym bardziej zasadowy będzie odczyn. Niemniej jednak użycie fenoloftaleiny jest uzasadnione.
No dobrze, ale który wskaźnik jest lepszy w tym przypadku i jak duża jest różnica wyniku pomiaru w zależności od użytego wskaźnika?
Poniższy wykres pokazuje jak (teoretycznie) kształtuje się pH roztworu, podczas gdy neutralizujemy słaby kwas mocną zasadą. Pionowa linia wyznacza miejsce, w którym cały kwas został zneutralizowany. Celowo nie zwymiarowałem osi, bo początkowa i końcowa wartość pH, jak również punkty przecięcia z osiami, zależą od konkretnej próbki. Jak widać im bliżej punktu równowagi, przebieg pH staje się coraz bardziej pionowy. Tak więc zdaje się, że wybór konkretnego indykatora może nie mieć aż tak dużego wpływu na wynik. Muszę to sprawdzić.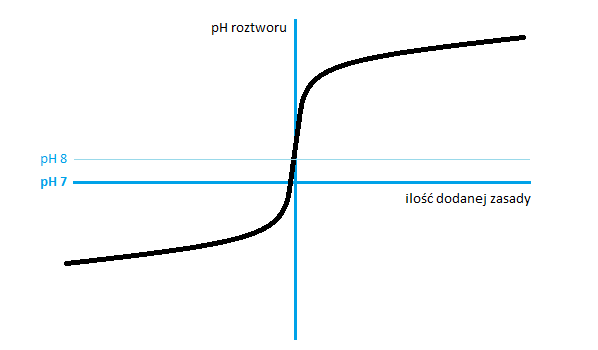
Niemniej jednak już na tym etapie nasuwa się ciekawy wniosek. W wielu źródłach, jak mantra powtarzana jest informacja, że owszem użycie chemicznych indykatorów jest dobre, ale jeśli chce się uzyskać na prawdę precyzyjny wynik, to należy monitorować poziom pH za pomocą pH metru. Tylko jaka jest docelowa wartość pH? Ci co używają BBT mówią, że docelową wartością jest 7, ci od fenoloftaleiny że 8,3, a tak jak to powiedzieliśmy przed chwilą faktyczna wartość docelowa zależy od początkowej zawartości kwasu w próbce. No to o jakiej lepszej dokładności możemy tu mówić?
Nie ma sensu kupować pH metru tylko i wyłącznie na potrzeby pomiaru zawartości kwasów. Chyba że akurat ma się już pH metr, wtedy można nie kupować indykatorów, chociaż moim zdaniem użycie indykatorów zdecydowanie ułatwia sprawę. Dlaczego? No właśnie, może przyjrzyjmy się wreszcie jak się robi taki pomiar w praktyce.
Pomiar kwasowości całkowitej
Proces pomiaru kwasowości nie jest skomplikowany i wygląda następująco.
Do małej zlewki, 50ml lub 100ml, wlewamy:
- 30ml destylowanej wody
- 1ml indykatora
(błękit bromotymolowy lub fenoloftameina) - 10ml soku lub cydru
W przypadku cydru, trzeba go uprzednio odgazować. Zamiast destylowanej wody nie można użyć ani kranówy ani przegotowanej wody. Dodatek wody ma na celu jedynie poprawienie czytelności – jej ilość nie wpływa na obliczenia.
Zdjęcie 1 – 1 ml BBT przygotowany do dodania do zlewki z 30ml wodą destylowaną
Zdjęcie 2 – 10ml młodego cydru gotowe do dodania
Zdjęcie 3 – Gotowa próbka: woda + BBT + sok
Następnie miareczkujemy, czyli powoli dodajemy do próbki zasadę. Jeśli wiemy mniej więcej czego się spodziewać to pierwsze mililitry można dodać szybciej, potem zwolnić tempo i dodawać kropla po kropli.
Zdjęcie 4 – Miareczkowanie
Trzeba pamiętać żeby dobrze mieszać w trakcie. Ja do tego celu używam szklanej bagietki: łatwo się ją czyści, no i nie reaguje z chemikaliami.
W pewnym momencie próbka zacznie zmieniać kolor. Jeśli używamy fenoloftaleiny sprawa jest prosta: jeśli barwa zacznie się trwale zmieniać, to znaczy nie będzie znikać po zamieszaniu i odczekaniu kilku sekund, pomiar uznajemy za zakończony.
Zdjęcie 5 – Próbka soku z fenoloftaleiną, w trakcie i na końcu miareczkowania
Jeśli używamy błękitu, sama zmiana barwy z pomarańczowej na ciemną nie oznacza zakończenia pomiaru. Barwa początkowo będzie wpadać w odcienie zieleni, podczas gdy docelowo chcemy żeby była niebieska. Dlatego w przypadku BBT warto zrobić próbkę referencyjną, która będzie miała taki kolor jaki mamy uzyskać.
Próbka referencyjna wymaga kolejnej małej zlewki, więc w przypadku pomiaru z użyciem BBT warto mieć dwie. Robimy ją tak, że do zlewki wlewamy:
- 25ml destylowanej wody
- 1ml BBT
- 10ml tego samego soku lub cydru
Następnie – dokładnie tak samo jak w przypadku normalnego pomiaru – dodajemy stopniowo zasady, aż do momentu jak barwa zmieni się na zielono-niebieską. I wtedy dodajemy 5ml bufora pH 7. Ma to na celu osiągnięcie roztworu o odczynie pH 7 i takich samych proporcjach objętości soku do całości.
Tak to wygląda w praktyce – na dalszym planie próbka referencyjna, bardziej niebieska, bliżej próbka w trakcie pomiaru:
Zdjęcie 6 – Pomiar za pomocą BBT, na dalszym planie próbka referencyjna
Trzeba nabrać trochę wprawy, bo nawet pomimo użycia próbki referencyjnej trudno jest jednoznacznie określić w którym momencie dokładnie należy przerwać pomiar. Np. w moim przypadku moment „no może już wystarczy” następuje zwykle zbyt wcześnie: do pH 7 (mierzonego pH metrem) brakuje zwykle kilku dziesiątych ml zasady. OK, pisałem że użycie pH metru jest bez sensu – w tym przypadku faktycznie może poprawić wynik, ale wydaje mi się że w moim konkretnym przypadku jest to raczej kwestia braku doświadczenia (i cierpliwości).
Poza tym zastosowanie pH metru ogranicza się tutaj w moim uznaniu do ewentualnej końcowej korekty. Prowadzenie miareczkowania z użyciem samego pH metru jest bardzo niepraktyczne: dodać kilka kropel, zamieszać, włożyć pH metr, zaczekać jak zmierzy, dodać kolejne kilka kropel, itd. Łatwo przy tym przegapić moment przejścia przez pH 7, bo następuje to dość szybko.
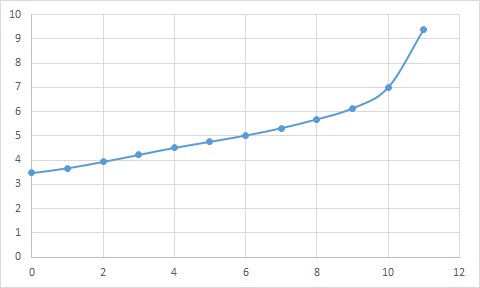
Z ciekawości zmierzyłem pH metrem jak zmienia się pH podczas dodawania kolejnych ml zasady do próbki. Oś x wyskalowana jest w ml zasady, na osi y wartości zmierzonego pH:
Przejście nie jest tak gwałtowne jak się spodziewałem. Widać że pH 7 osiągamy po dodaniu 10ml, podczas gdy do osiągnięcia pH 8 z hakiem (wartości progowej dla fenoloftaleiny) potrzeba dodatkowo rzędu 0,5 ml.
Przeprowadziłem kilka pomiarów, i wychodzi mi tak:
- mierząc na oko używając jako wskaźnika BBT i bazując na barwie próbki referencyjnej określam objętość zasady na 9,5ml
- korygując za pomocą pH metru do uzyskania dokładnie pH 7 dostaję 10ml
- używając fenoloftaleiny jako wskaźnika, rezultat jest o kolejne 0,5ml większy i wynosi 10,5ml.
Trochę się te wyniki różnią…
Dobrze, ale jak już uważamy że znamy objętość zasady konieczną do zneutralizowania kwasu w naszej próbce, kwasowość całkowitą wylicza się ze wzoru:
mkwasu = 0,67 * Vzasady
Objętość zasady podajemy w [mL], wynik jest w [g/L].
Przekładając wyniki moich pomiarów na zawartość kwasu, rezultat waha się w granicach 6,4 – 7 [g/L]. Czyli jednak jest pewna różnica, procentowo nawet dość znacząca. Pisałem już, że jest to wynik orientacyjny? 😉
Biurety i strzykawki
Przy miareczkowaniu wygodnie jest posłużyć się biuretą:
Zdjęcie 7 – Biureta
Ta konkretna ma plastikowy zbiornik o pojemności 1L, i kolumnę o pojemności 25mL ze skalą o dokładności 0,1mL.
Działa to tak, że do zbiornika nalewamy sobie zasadę, zakręcamy, i następnie napełniamy kolumnę po prostu ściskając zbiornik. Do napełniania zbiornika może przydać się mały lejek, szczególnie jeśli butelka z zasadą ma duży otwór, bo otwór w biurecie jest dość mały, a rozlewanie zasady po stole nie jest tym na czym nam szczególnie zależy.
Kolumna jest tak wyskalowana, że poziom „0” jest na samej górze. Napełnianie do poziomu „0” jest ułatwione przez to że na górze kolumny jest taka specjalna mała rurka, która po puszczeniu zbiornika odciągnie nadmiar cieczy dokładnie do „0”:
Zdjęcie 8 – Szczyt kolumny biurety
Widać, że na cieczy w kolumnie tworzy się menisk – trzeba się zdecydować czy patrzymy na jego szczyt, środek, czy spód – i konsekwentnie się tego trzymać.
Na dole komuny jest zawór, który wiadomo trzeba nacisnąć, ale ponieważ zależy nam zwykle na tym żeby ciecz z biurety powoli kapała, i nie chcemy przy tym ciągle trzymać, jest takie małe pokrętełko które służy do precyzyjnego naciśnięcia zaworu:
Zdjęcie 9 – Zawór biurety
Trzeba uważać i powoli zwiększać nacisk, bo jak przyciśnie się zbyt mocno, to zamiast kapać, biureta siknie nam strumyczkiem zasady, zwykle poza podstawione naczynie.
Jeśli chodzi o pojemność kolumny, to doszedłem (oczywiście po fakcie) do wniosku, że 25ml to za dużo na moje potrzeby. Wystarczyłoby mi 15ml, dzięki temu biureta byłaby niższa i łatwiej byłoby ją schować – ta konkretna ma 65cm wysokości. To że 15ml mogłoby nie wystarczyć w przypadku soku o dużej zawartości kwasu to nie problem – przecież zawsze mogę ponownie napełnić kolumnę.
Biureta jest o tyle wygodna, że napełnia się ją raz, po czym można sobie mierzyć wiele próbek, za każdym razem jedynie ściskając zbiornik żeby uzupełnić kolumnę. Podczas miareczkowania obie ręce są wolne, a to się przydaje jak trzeba jednocześnie trzymać zlewkę i mieszać.
Wadą biurety jest to, że trzeba się najpierw z nią rozłożyć, wlać do zbiornika mniej więcej tyle zasady ile będzie potrzebne żeby nie musieć potem przelewać z powrotem, a na koniec trzeba ją przelać i wypłukać. Jest to dość zniechęcająca perspektywa, jeśli ma się do zmierzenia tylko jedną próbkę.
I tu dochodzimy do wersji alternatywnej – zamiast biurety równie dobrze można użyć strzykawki. Najlepiej z igłą, bo wtedy można uzyskać mniejsze krople i dokładniej podawać zasadę. Strzykawka ma taką zaletę że jest tak średnio o dwa rzędy wielkości tańsza, a przy odrobinie wprawy pozwala uzyskać dokładnie taki sam wynik. Ważne, żeby podziałka była dokładna. Można użyć różnych strzykawek – większej, z mniej dokładną podziałką do odmierzenia początkowej objętości, i mniejszej z dokładniejszą podziałką do końcowego odmierzenia dziesiątych części ml. Wada jest taka, że używając strzykawki, do mieszania i trzymania zlewki zostaje jedna ręka, ale można sobie z tym poradzić.
Prawda jest taka, że mając do zmierzenia jedną próbkę, sięgam po prostu po strzykawkę.
Akcesoria
Przykładowy zestaw akcesoriów do pomiaru kwasowości wygląda tak:
Zdjęcie 10 – Przykładowy zestaw do pomiary kwasowości całkowitej
Ewentualnie, jeśli mamy w planie użyć fenoloftaleinę, to potrzebna jest tylko jedna zlewka, i nie potrzeba bufora pH 7.
I tak jak pisałem: zamiast biurety, do miareczkowania można równie dobrze użyć strzykawki z igłą – warto żeby podziałka miała dokładność 0,5ml lub lepszą.
A, ta dziwna konewka po prawej – tam mam moją „wodę destylowaną”. Konkretnie jest to woda z suszarki do ubrań – suszarka odparowuje wodę a następnie skrapla ją do zbiornika, i o to chodzi.
Do pobierania 10ml próbki soku można użyć strzykawki, ale jeśli chcemy pobrać próbkę cydru z fermentora, strzykawka może nie sięgnąć powierzchni – w takim przypadku wygodnie posłużyć się taką pipetą:
Zdjęcie 11 – Pipeta 10ml
Można do niej dokupić pompkę, albo po prostu zaciągnąć ustami – dopóki nie będziemy w ten sposób odmierzać chemikaliów, przy odrobinie nieuwagi (a może i celowo) można co najwyżej trochę się napić.
Fermentacja jabłkowo-mlekowa
Nie, nie mam zamiaru wchodzić tutaj w szczegóły o co chodzi w fermentacji jabłkowo-mlekowej – to jest osobny temat. Niemniej jednak jako że ten proces – jeśli w ogóle wystąpi, co nie jest powiedziane – ma wpływ na końcową zawartość kwasów w cydrze, warto co nieco o tym widzieć.
Bakterie, które powodują przemianę jabłkowo-mlekową, rozkładają kwas jabłkowy na kwas mlekowy i dwutlenek węgla:
C4H6O5 -> C3H6O3 + CO2
Nie zmienia się liczba cząsteczek kwasu, ale co istotne: do zobojętnienia cząsteczki kwasu mlekowego potrzeba tylko jednej – a nie dwóch jak w przypadku kwasu jabłkowego – cząsteczki NaOH.
C3H6O3 + NaOH -> NaC3H5O3 + H2O
Co za tym idzie objętość zasady potrzebna do zneutralizowania tego kwasu jest dwa razy mniejsza, i w zależności od tego ile kwasu jabłkowego zostało przetworzone na kwas mlekowy, wyliczona przez nas na podstawie objętości dodanej zasady kwasowość całkowita może wykazać spadek nawet rzędu 50%.
W przypadku gdy duża ilość kwasu jabłkowego została przetworzona na kwas mlekowy, wyliczona na podstawie miareczkowania masa kwasu ma się kompletnie nijak do rzeczywistości, bo raz że cząsteczek jest dwa razy więcej niż założyliśmy w obliczeniach, jak również ich masa jest inna niż cząsteczek kwasu jabłkowego. Niemniej jednak informacja o spadku kwasowości całkowitej nie jest bezużyteczna, bo dzięki niej wiemy że ma miejsce fermentacja jabłkowo-mlekowa, jak również jesteśmy w stanie oszacować na jakim etapie się ona znajduje, to znaczy ile jeszcze pozostało kwasu jabłkowego.
Podsumowanie
To tyle co na razie wiem o kwasach. Nie było nic o metodach zwiększania czy też obniżania kwasowości za pomocą różnych dodatków, ale po prostu nigdy tego nie robiłem, więc nie będę się wymądrzał.
Ogólnie moje odczucie jest takie że owszem warto wiedzieć ile kwasu jest w soku żeby docelowy cydr nie przyniósł niechcianych smakowych niespodzianek. Jednak pomiar zawartości kwasu jest obarczony wieloma błędami i dużo zależy od konkretnej metody jak i osoby przeprowadzającej pomiar. Warto wyćwiczyć sobie jeden sposób, i trzymać się go żeby mieć możliwość porównywania własnych wyników.
Jeśli w ogóle chce się tą kwasowość mierzyć. Być może trzeba mieć tutaj mniej naukowe podejście i bardziej polegać po prostu na smaku?
Następnym razem będzie o pH.












Fenoloftaleiny nie potrzeba dużo. Obecnie używam ~3 krople na 10ml, bo akurat mam taką w buteleczce z zakraplaczem. Nie spotkałem się nigdzie z zastrzeżeniami, żeby uważać z ilością wskaźnika – ale to łatwo sprawdzić, robiąc kilka prób na tym samym soku, z różną ilością wskaźnika.
A to jeszcze spytam o fenoloftaleine. Chemik że mnie marny dziś. W gimnazjum miwlem 5 e to było 20 lat temu.
Sposób wydaje się łatwiejszy bo nie musisz używać bufora. A i pomiar może być dokladniekszy przy dodawaniu powiedzmy po 0.1ml NaOH i dokładnym wymieszaniu.
Naszła mnie pewna wątpliwość i rozterka. Czy ilość bbt albo fenoloftaleiny gra rolę? Widzę że dodajesz po 1ml na 10ml soku. Czy istotna jesy proporcja albo stężenie wskaźnika? Czy dodaje się go jak najmniej aby nie zaburzył Vsoku i jego gęstości oraz tyle aby był dobrze widoczny?
Ja kupowałem w Marxam. Alternatywnie możesz kupić wodorotlenek w granulkach, do analizy, i rozcieńczyć w odpowiedniej proporcji – na amatorskie potrzeby dokładność wystarczająca.
Gdzie można kupić wodorotlenek sodu o stężeniu 0,1mol/L? ja na alledrogo widzę tylko ok 19mol/L a to o rząd wielkości za dużo i ciężko tym operować
Tak, wprowadziliśmy cydry do oferty analitycznej. W tym roku podpisaliśmy już nawet umowę o stałej współpracy z jedną z cydrowni.
Polskie rozporządzenia dotyczące badań cydru są, w głównej mierze, tłumaczeniami wytycznych OIV (Międzynarodowa Organizacja Winorośli i Wina), więc metodologicznie i aparaturowo byliśmy już na to przygotowani.
Z cydrem zapraszam. A dokładność Twoich pomiarów ograniczać może co najwyżej sprzęt, bo skrupulatności (jak widzę po lekturze bloga) Ci nie brak.
Widzę, że zajmujecie się profesjonalną analizą parametrów cydru. Bardzo się cieszę, bo do tej pory nie było u nas łatwo o takie badania. Po wakacjach zgłoszę się z cydrem do przebadania, ciekawe na ile dokładne są moje amatorskie pomiary.
> Widać, że na cieczy w kolumnie tworzy się menisk – trzeba się zdecydować czy patrzymy na jego szczyt, środek, czy spód – i konsekwentnie się tego trzymać.
Jeżeli biureta jest wyposażona w pasek Schellbacha, to nie ma potrzeby decydować 😉 Przykładowa instrukcja odczytu: https://www.bionovo.pl/wp-content/uploads/2017/04/Biurety-proste-prze%C5%BAroczyste-kl.-AS-z-paskiem-Schellbacha-3.jpg
Ja kupiłem płynną – faktycznie na etykiecie stoi że to 1% roztwór w alkoholu etylowym. Wrzuć „phenolphthalein denatured indicator” na Google – pierwsze kilka trafień to komercyjnie wskaźniki na bazie denaturatu, więc pomysł jak najbardziej trafiony!
Również zamierzam mierzyć zawartość kwasu w soku jabłkowym używając fenoloftaleiny. Zakupiłem fenoloftaleinę w postaci proszku o czystości min. 99% jak podaje sprzedawca. Przeczytałem w internecie, że do miareczkowania stosuje się 1%-owy roztwór fenoloftaleiny i etanolu. Czy mogę do tego celu użyć bezbarwnego denaturatu?