Prędzej czy później przyjdzie ten moment, kiedy zdecyduję, że czas zabutelkować cydr. I wtedy – jak co roku – niezawodnie pojawi się pytanie: gazować czy nie gazować? Odpowiedź, jak zwykle, będzie taka sama – bo o ile nie jest wcale powiedziane, że cydr musi mieć bąbelki, ja wolę jak musuje.
Tak więc w kolejce niecierpliwie ustawią się następne wymagające rozstrzygnięcia kwestie: to ile właściwie tego cukru mam dodać? Cukru, a może glukozy? A jakby tak, tym razem, sztucznie nagazować? I dalej, w ten deseń…
Przeważnie kończy się na 3g „czego tam akurat mam pod ręką” na 0,5L butelkę – bo tak gdzieś kiedyś przeczytałem, i w sumie się sprawdza. Ale pomyślałem, że może tym razem poedukuję się trochę w temacie, i nawet jeśli pozostanę przy moich 3g, to przynajmniej będę wiedział skąd wzięła się właśnie taka ilość.
Nie chcę wchodzić tutaj w kwestie tego czy, a jeśli tak to jak bardzo, powinien być nagazowany cydr. Jedni lubią bez gazu, inni stoją na stanowisku, że jego brak pozbawia napój życia i to właśnie bąbelki pozwalają wyłowić te najważniejsze, głęboko zatopione aromaty. Z kolei wśród miłośników bąbelków będą tacy, którym wystarczy lekkie musowanie, podczas gdy inni za jedyny słuszny uznają poziom gazu jakiego nie powstydziłby się najlepszy szampan. Każdy musi zdecydować sam co najbardziej mu odpowiada – a akurat jesteśmy w tej komfortowej sytuacji, że możemy zrobić dokładnie tak, jak to sobie wymyślimy 🙂
Rozpuszczalność gazów
„Gaz” w napojach gazowanych to nic innego jak rozpuszczony dwutlenek węgla, CO2. Gazy, ogólnie, mają taką właściwość że rozpuszczają się w cieczy w funkcji ciśnienia i temperatury: rozpuszczalność wzrasta wraz ze spadkiem temperatury, jak również ze wzrostem ciśnienia na styku gazu z cieczą.
Mówiąc o ciśnieniu, warto zaznaczyć, że chodzi tutaj o ciśnienie cząstkowe, to znaczy ciśnienie tego konkretnego gazu, którego rozpuszczalność nas interesuje. Jeśli mamy mieszaninę dwóch gazów A (30%) i B (70%), pod ciśnieniem 1atm, to ciśnienia cząstkowe wynoszą odpowiednio 0,3 i 0,7atm.
Rozpuszczanie gazów jest procesem powolnym. Po zwiększeniu ciśnienia i/lub spadku temperatury ciecz nie zacznie z sykiem wciągać gazów z otoczenia: zacznie je powoli absorbować, co może potrwać dni czy nawet tygodnie – ale koniec końców dojdzie do ustalenia się tak zwanego stanu równowagi.
Prawo Henry’ego
To, ile konkretnie gazu jest rozpuszczone w stanie równowagi, odpowiadającym danym warunkom, da się łatwo wyliczyć przy użyciu tak zwanego prawa Henry’ego, które mówi, że:
c = H * p
czyli że ilość rozpuszczonego gazu (c) jest proporcjonalna do ciśnienia cząstkowego tego gazu (p). Współczynnik proporcjonalności (H) to „stała Henry’ego” – która swoją drogą ze „stałą” ma niewiele wspólnego, bo nie dość że jest inna w zależności od gazu, to dodatkowo zależy od temperatury.
Zależność stałej Henry’ego od temperatury (t) dana jest takim wzorem:
H = Hstd * exp ( T * ( 1 / t – 1 / tstd ) )
Hstd to jest wartość stałej Henry’ego w temperaturze “stanu standardowego” (tstd), czyli 25C. T to jest współczynnik zależności od temperatury. Zaś exp to jest „e” do potęgi.
Wartości zarówno Hstd jak i T znajdują się w tabelach. Np. tutaj jest bardziej niż kompletna lista gazów i odpowiadających im wartości. Niemniej jednak, nam wystarczy wiedzieć, że:
Hstd CO2 = 0,00033 [mol/m3/Pa]
TCO2 = 2400
Hstd O2 = 0,000012 [mol/m3/Pa]
TO2 = 1700
Hstd N2 = 0,0000064 [mol/m3/Pa]
TN2 = 1600
Wynika z tego, że tlen rozpuszcza się w wodzie 30 razy gorzej od dwutlenku węgla, a azot aż 50 razy gorzej.
Powyżej pojawiły się pierwsze jednostki – trzeba pamiętać, żeby na potrzeby wzorów temperaturę wyrażać w Kelvin’ach, ciśnienie w Pascal’ach, a objętość w metrach sześciennych – za co wzory zrewanżują się nam molami 🙂
Przykładowe obliczenia
No to policzmy sobie coś szybko, żeby się oswoić. Załóżmy, że mamy szczelnie zamknięty pojemnik, w którym mamy wodę oraz wyłącznie dwutlenek węgla, mamy stan równowagi, ciśnienie dwutlenku węgla wynosi 1 atm. A, no i temperatura jest załóżmy 20C.
Najpierw trzeba przejść na odpowiednie jednostki:
- 1 atm to 101325 Pa (1013,25 hektopaskali)
- 20C to 293,15K
- 25C (tstd) to 298,15K
Podstawiając liczby do wzoru, ilość rozpuszczonego dwutlenku węgla wynosi:
c = 0,00033 * exp (2400 * (1/293,15 – 1/298,15)) = 38,36 mol/m3
Czyli dowiadujemy się, że w takich warunkach, w metrze sześciennym wody będzie rozpuszczone 38,36 moli CO2.
Nic nie powiedzieliśmy do tej pory ile mamy w naszym pojemniku wody. Załóżmy, dla uproszczenia, że jest jej 1L. Nie ma tutaj znaczenia całkowita pojemność pojemnika – ważne że jest jakaś wolna przestrzeń, która jest wypełniona CO2 o znanym ciśnieniu.
Mówiąc o ciśnieniu koniecznie trzeba sobie uświadomić, że to ciśnienie 1 atm, którym posługujemy się w powyższych obliczeniach, to ciśnienie bezwzględne.
Jeśli do naszego pojemnika z powyższego przykładu podłączylibyśmy manometr, wskazówka pokazałaby ~0, dlatego że manometr (taki zwykły) pokazuje ciśnienie względne, względem otaczającego manometr ciśnienia atmosferycznego. Stąd „~0”, bo jeśli zamkniemy pojemnik przy ciśnieniu 1atm, a potem przyjdzie np. niż, wskazówka delikatnie wychyli się na plus.
Wracając do obliczeń: znając objętość płynu, możemy wyliczyć konkretną ilość rozpuszczonego gazu. Skoro w 1000L byłoby go 38,36 mola, to w naszym litrze będzie go 1000x mniej: 0,03836 mola.
Znając ilość moli, wiemy już w zasadzie wszystko – było kiedyś na chemii, że mol to taka sprytna jednostka, z której bez problemu można wyliczyć zarówno masę jak i objętość gazu 🙂
Masa mola substancji odpowiada sumie mas atomowych pierwiastków wchodzących w jej skład, wyrażonej w gramach. Masę atomową bierze się z tablic Mendelejewa. Taki węgiel ma masę atomową w przybliżeniu 12, tlen 14 – stąd masa mola CO2 to 44g.
Objętość mola gazu wynosi 22,415L – w tak zwanych warunkach normalnych, czyli w temperaturze 0C i ciśnieniu 1 atm, niezależnie od rodzaju gazu.
Czyli w naszym przypadku, w litrze płynu rozpuszczone będzie 44g * 0,03836 = 1,69g CO2, co przekłada się na objętość 0,86L.
Spokojne i musujące
I to właśnie jest najpopularniejszy sposób wyrażania poziomu „nagazowania” dwutlenkiem węgla: poprzez określenie ile takich „normalnych” objętości CO2 jest rozpuszczone w danej objętości cieczy. W naszym przypadku, poziom nasycenia cieczy dwutlenkiem węgla wynosi 0,86L / 1L = 0,86 [vol CO2].
W zależności od stopnia nasycenia CO2, cydry przyjęło się dzielić na:
- spokojne, <1 vol CO2
- półmusujące, 1.5-2.5 vol CO2
- musujące, 3.5-5.5 vol CO2
- wybuchające, >5.5 vol CO2 😉
Nie jest to do końca zgodne z tym co możemy znaleźć w w naszym polskim prawodawstwie (link) – ale raz, że jest tam mowa ogólnie o wyrobach winiarskich, a poza tym nie jestem pewien o jakim konkretnie ciśnieniu mówią – względnym, bezwzględnym – więc w sumie nie traktuję tego rozporządzenia jako wyznacznika.
Czasami w powyższej klasyfikacji pojawia się podatkowo cydr „perlisty”, na granicy między spokojnym i półmusującym. Taki perlisty cydr po otwarciu nie będzie miał tendencji do musowania, ale będzie uwalniał sporadyczne bąbelki, co podobno pozytywnie wpływa na walory smakowe. Nie jestem do końca przekonany do tej koncepcji – napoje o nasyceniu 1 vol CO2, i niższym, również będą uwalniać CO2 po otwarciu.
Po otwarciu butelki
Po otwarciu pojemnika/butelki ciśnienie cząstkowe CO2 spada praktycznie do zera i układ dąży do nowego stanu równowagi, w którym nie ma miejsca na tyle rozpuszczonego CO2.
Powietrze składa się z: azotu (~78%), tlenu (~21%), argonu (~1%), dwutlenku węgla (~0,04%) i jeszcze kilku innych gazów w ilościach śladowych. Przy ciśnieniu atmosferycznym 1 atm ciśnienie cząstkowe CO2 wynosi ~0,0004atm.
Czyli jak otworzymy nasz przykładowy pojemnik, nowy stan równowagi w temperaturze 20C ustali się na poziomie <0,0003 vol CO2 – czyli praktycznie cały rozpuszczony w cieczy dwutlenek węgla uleci do atmosfery – pozostanie gaz o objętości <0,3mL. Temperatura właściwie nic tu zmienia: np. przy 4C pozostałoby ~0,4mL CO2 – choć oczywiście przy niższej temperaturze stan równowagi będzie ustalał się dłużej; wiadomo, że napoje schłodzone bąbelkują wolniej.
Zmiana objętości gazu
Tak z ciekawości – jeśli mamy taki płyn o nasyceniu 1 vol CO2, czyli mówimy że mamy 1L CO2 (stan normalny) rozpuszczony w każdym litrze, to jaką objętość miałby ten gaz w temperaturze 20C, i załóżmy tym samym ciśnieniu: 1atm?
Kolejny dobrze znany wzór się kłania: pV = nRT, skąd interesuje nas V.
n to liczba moli gazu, którą wyliczamy z prostej zależności: jeśli 1 mol gazu ma objętość 22,4L to 1L gazu to 1/22,4 = 0,045 mola. R to stała gazowa (taka prawdziwa stała) o wartości niezmiennie równej 8,3144598(48) J/mol/K.
Przeliczając dla zadanych wartości:
V = nRT / p = 0,045 * 8,314459848 * 293,15/101325 [mol * J / mol / K * K / Pa]
= 0,00108248 [J / Pa]
Joul to inaczej Pa*m3, stąd liczona przez nas objętość to 1,08248 L.
Czyli właśnie sprawdziliśmy sobie, że wzrost temperatury z 0C do 20C powoduje wzrost objętości początkowego 1L gazu o ~82mL.
Czyli pomimo tego, że niezależnie od temperatury z otwartej butelki ulotni się praktycznie taka sama ilość/masa gazu, to w temperaturze 20C gaz ten będzie miał o ~8% większą objętość niż w 0C.
Sposoby gazowania cydru
Dobrze, ale miało być o gazowaniu cydru, a na razie jedyny związek jest taki, że po tym wstępie chciałoby się cydru napić 😉 Na szczęście właśnie przebrnęliśmy przez całą „teorię”.
No to jak to jest z tymi bąbelkami w cydrze, skąd się bierze ten dwutlenek węgla?
Jeśli ktoś miał wcześniej do czynienia z robieniem piwa, to w przypadku cydru nie ma na tym etapie żadnych różnic: piwo i cydr gazuje się tak samo. Są dwa główne sposoby: refermentacja w butelkach (ew. innych pojemnikach) oraz sztuczne gazowanie w keg’ach.
Pierwszy sposób polega na tym, że butelkuje się cydr, który już skończył fermentację, dodaje trochę cukru, zamyka, i zostawia w spokoju na pewien czas. W tym czasie pozostałe przy życiu drożdżowe niedobitki mnożą się, na tyle na ile pozwalają im warunki – a te nie są już sprzyjające ze względu na małą ilość tlenu zarówno w płynie jak i w szyjce butelki – po czym powoli konsumują cukier odwdzięczając się nam za to dwutlenkiem węgla. Jako że butelka jest zamknięta, CO2 nie ma gdzie uciec, w efekcie powoli wzrasta ciśnienie, a co za tym idzie wzrasta ilość rozpuszczonego w cydrze gazu.
Im dłużej cydr dojrzewał w fermentorze, tym mniej pozostałych w nim drożdży. Niemniej jednak nie spotkałem się jeszcze z sytuacją, żeby refermentacja nie powiodła się ze względu na ich brak. Oczywiście im mniej drożdży tym dłużej to zajmie zanim cydr się nagazuje. W moim przypadku, gdy butelkowałem całkowicie sklarowane cydry, które stały w fermentorze przez kilka miesięcy, proces refermentacji trwał kolejne kilka miesięcy.
Chcąc przyspieszyć ten proces można rozważyć dodanie odrobiny sproszkowanych drożdży, w ilości np. 1/10 zalecanej dawki, do tego ew. odrobiny pożywki. Ale trzeba pamiętać że o ile dodatek drożdży korzystnie wpłynie na szybkość refermentacji, to skutkiem ubocznym będzie ponowne pojawienie się silnego drożdżowego aromatu, i znów sporo czasu przyjdzie poczekać na jego zaniknięcie. I o ile drożdżowe nuty koniec końców ucichną, o tyle same drożdże pozostaną, w formie zalegającego na dnie butelki osadu. Osad tak czy siak będzie, niezależnie od tego czy dodaliśmy drożdży czy nie – patrz choćby ile osadu powstało tutaj, pomimo że nie dodawałem żadnych drożdży – ale im szybsza refermentacja / większa populacja drożdży, tym większy koniec końców osad.
Szybkość refermentacji można wspomóc pozostawiając właśnie zabutelkowany cydr na kilka dni w pokojowej temperaturze.
Refermentacja z dodatkiem cukru jest o tyle wygodna, że daje nam dobrą kontrolę nad efektem końcowym: dokładnie wiemy ile cukru dodajemy, więc możemy dość celnie określić ile powstanie CO2, a co za tym idzie jaki będzie poziom nagazowania.
Zamiast cukru można użyć soku jabłkowego. Może to być ten sam sok, z którego robimy cydr, uprzednio zamrożony w tym właśnie celu. Może to być inny sok. Problem ze słodzeniem sokiem polega na tym, że sok sokowi nierówny i różnice w zawartości cukru potrafią być dość spore. Przykładowo, przeciętny sok o SG 1.047 zawiera ~100g cukru w litrze, podczas gdy sok o SG 1.070 (który nota bene udało mi się niedawno wycisnąć z Renet) zawiera aż 50% cukru więcej! W przeliczaniu SG na zawartość cukru pomocny jest kalkulator. Trzeba pamiętać, że dodając sok zwiększa się całkowitą objętość, więc jeśli do 1L cydru dodamy 100mL soku o SG 1.047, zawartość cukru wyniesie 10g/1,1L.
Ciekawą alternatywą jest butelkowanie cydru, który jeszcze do końca nie odfermentował. Ogólna zasada pozostaje bez zmian, ale zamiast dodawać cukier/sok wykorzystujemy jeszcze nieprzefermentowany cukier wciąż obecny w cydrze.
Zaletą tej metody jest to, że otrzymujemy gazowany cydr bez żadnych dodatków – niektórzy twierdzą że dodatek cukru, choć niewielki, da się wyczuć w smaku. Wada jest taka, że nie do końca wiadomo jakie będzie końcowe SG cydru, więc trudno jest określić, znając jedynie obecny ciężar właściwy, ile tego cukru jeszcze pozostało do odfermentowania.
Szacując końcowe SG można posłużyć się wspomnianym kalkulatorem, choć dla większej pewności lepiej szybko odfermentować do końca próbkę cydru w wyższej temperaturze, i posłużyć się zmierzonym SG jako wartością odniesienia. Spadek SG o 0,001 odpowiada przefermentowaniu 2g/L cukru.
Problemem może być „złapanie” cydru w odpowiednim momencie, gdy ma dokładnie oczekiwany przez nas poziom SG – szczególnie jeśli fermentujemy z dodatkiem pożywek, w pokojowej temperaturze – w takich warunkach akcja fermentacja potrafi toczyć się bardzo szybko. Trzeba się również liczyć z większą ilością osadu, bo butelkowany cydr będzie daleki od klarowności, a wszystkie te wzbite cząsteczki kiedyś opadną na dno.
O ile zwykle o refermentacji mówi się w kontekście butelkowania, o tyle równie dobrze można refermentować w większym pojemniku, np. w keg’u. Chociaż mając keg, łatwo ulec pokusie sztucznego nagazowania.
Sztuczne gazowanie
Przeglądając regulacje prawne dotyczące wyrobów winiarskich, z zaskoczeniem spostrzegłem że wina mogą być „musujące” i „musujące gazowane”. Intuicyjnie pomyślałem, że te „gazowane” będą miały trochę więcej bąbelków niż takie po prostu „musujące”. Jednak szybko okazało się, że różnica nie polega bynajmniej na zawartości dwutlenku węgla, a na sposobie w jakim napój został nasycony CO2. Dopisek „gazowany” oznacza że nagazowanie zostało osiągnięte w sposób sztuczny – tzn. nie przez refermentację.
Sztuczne nagazowanie jest w zasadzie bardzo proste. Polega na zamknięciu odfermentowanego cydru w pojemniku i podaniu CO2 pod odpowiednim ciśnieniem. W rezultacie, zgodnie z prawem Henry’ego, dwutlenek węgla rozpuszcza się w płynie, po pewnym czasie osiągając stan równowagi względem panującego nad powierzchnią ciśnienia. Co jest tutaj istotne, to że nie wystarczy raz podać gaz i następnie odłączyć butlę: gaz musi być podawany ciągle, lub przynajmniej regularnie uzupełniany, ponieważ z czasem – na początku szybciej, potem coraz wolniej – będzie się rozpuszczał w płynie, a co za tym idzie jego ciśnienie w wolnej objętości będzie maleć.
Takie sztuczne gazowanie jest procesem dość czasochłonnym. W moim przypadku ustalenie się stanu równowagi, przy zadanym ciśnieniu 2 bary (na regulatorze/manometrze), trwało około dwa tygodnie. Po tym czasie potrząsanie keg’iem nie powodowało już charakterystycznego szumu w regulatorze: ustał przepływ gazu z butli do keg’a.
Z tym że ja posłużyłem się dość mało agresywną metodą: napełniłem keg praktycznie do pełna, ustawiłem na regulatorze ciśnienie, położyłem keg na boku (żeby zwiększyć powierzchnię kontaktu cieczy z gazem), poturlałem nim tam i z powrotem przez kilka minut (cały czas wyraźnie było słychać dopływający z butli gaz), po czym zostawiłem taki leżący keg i doglądałem go raz dziennie, słuchając czy przy potrząsaniu gaz wciąż dopływa.
Są bardziej radykalne metody, polegające np. na tym że podaje się do keg’a maksymalne ciśnienie na jakie pozwala zawór bezpieczeństwa (~5 bar), dzięki czemu saturacja przebiega szybciej, a po kilku dniach spuszcza się gaz do docelowego ciśnienia.
Niektórzy twierdzą że proces można przyspieszyć podając gaz „od dołu”, to znaczy podpinając butlę do króćca który normalnie służy do nalewania. W przypadku keg’a Cornelius trzeba w tym celu podpiąć rurkę z butli do czarnego króćca – samych króćców na keg’u zamienić się nie da, bo wbrew pozorom ich przyłącza się różnią (!), właśnie po to żeby uniknąć pomyłek.
To jaką metodą się posłużymy zależy zasadniczo od tego jak bardzo nam się spieszy. Tak czy inaczej, cała filozofia polega na określeniu jakie nasycenie CO2 nas interesuje, oraz ustawienia regulatora na ciśnienie odpowiednie dla temperatury, którą akurat „dysponujemy”. Im wyższa temperatura, tym większe ciśnienie będzie potrzebne do uzyskania założonego poziomu nasycenia.
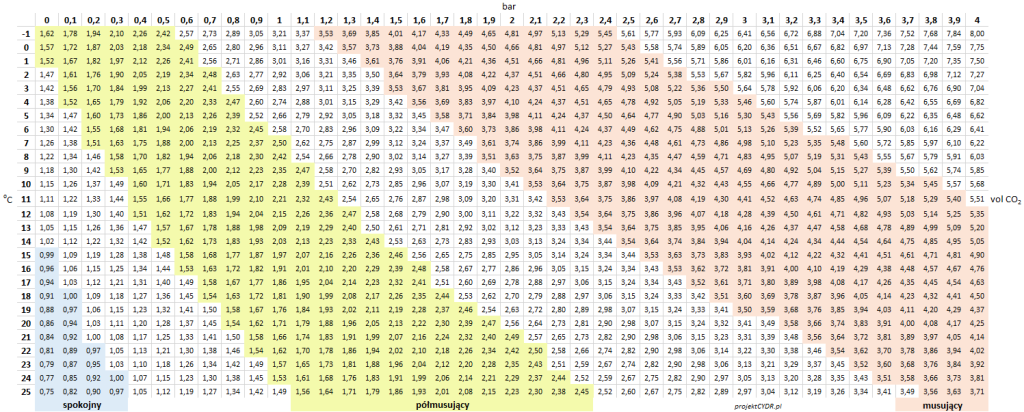
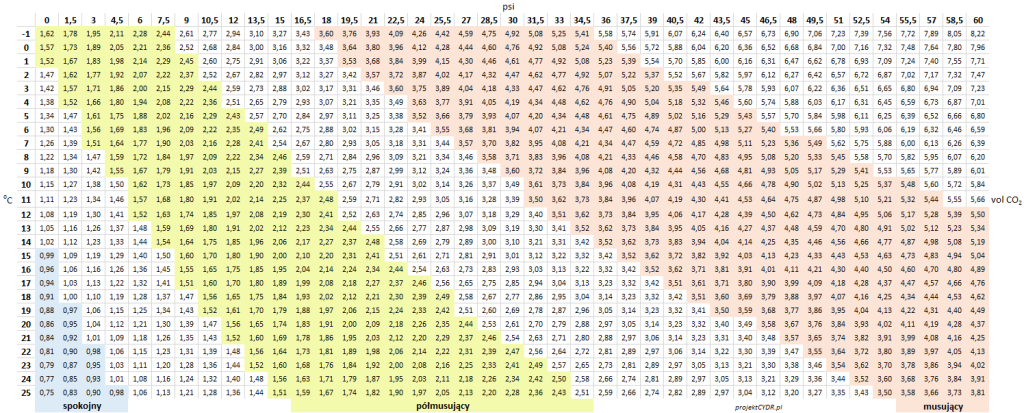
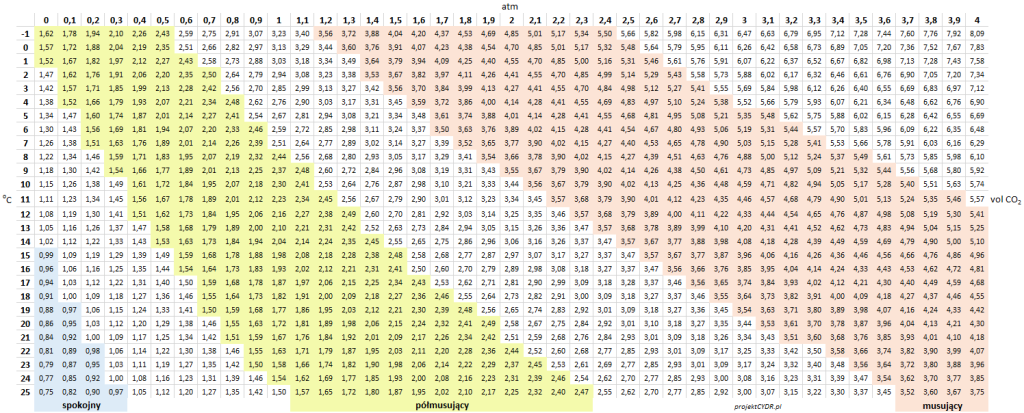
O ile oczywiście wszystko można sobie przeliczyć z prawa Henry’ego, o tyle praktyczne są tutaj następujące tabelki. Zaznaczam, że to jest ciśnienie względne: „na manometrze”.
Dla wygody zrobiłem trzy tabelki, w zależności w czym tam akurat wyskalowany jest manometr:
Tabela 1 – Poziomy nasycenia dwutlenkiem węgla, w zależności od ciśnienia i temperatury
Warto zwrócić uwagę, że nawet przy zerowym ciśnieniu względnym mamy już pewne nasycenie CO2 – i to nie byle jakie, bo przy niskich temperaturach przekraczające 1 vol CO2.
„0 atm” to warunki, w których przestrzeń nad płynem wypełniona jest dwutlenkiem węgla o ciśnieniu atmosferycznym. Nie jest to może praktyczny scenariusz w przypadku keg’a, bo zawsze trzeba trochę zwiększyć ciśnienie w środku, żeby wieko „chwyciło” – ale takie warunki panują przykładowo w zamkniętym rurką fermentorze.
Już samo pozostawienie fermentora w chłodnym miejscu (zakładając że nie straciliśmy wypełniającego go CO2) powoduje, że osiągamy pewne wstępne nasycenie. W przypadku keg’owania, im większe wstępne nasycenie tym mniej gazu z butli zużyjemy, a w przypadku refermentacji przełoży się na mniejszy dodatek cukru.
Wlewając cydr do keg’a, żeby uniknąć utraty rozpuszczonego gazu oraz zapobiec napowietrzeniu, warto wstępnie przedmuchać zbiornik dwutlenkiem węgla, a samo nalewanie przeprowadzać delikatnie, z rurką sięgającą dna zbiornika. Zamykając keg trzeba pamiętać, żeby ponownie „przewietrzyć” go CO2, np. kilkakrotnie wypuścić gaz przez zawór bezpieczeństwa.
Powyższe tabelka zakłada takie właśnie „idealne” warunki: keg’ujemy wstępnie nasycony cydr, a wolną przestrzeń wypełniamy CO2. Niespełnienie tych warunków spowoduje, że końcowy poziom nasycenia będzie mniejszy.
Zmiany temperatury keg’a
No dobrze. Teraz załóżmy sytuację, że już nagazowaliśmy sobie cydr, ciśnienie się ustaliło, nie trzeba już dodawać gazu – i teraz przenosimy keg w inne miejsce, gdzie panuje inna temperatura. Czy poziom nagazowania pozostanie taki sam?
Wszystko zależy of tego ile cydru zostało nam w keg’u. Jeśli mamy praktycznie pełny keg, zmiany temperatury nie wpłyną zauważalnie na poziom nagazowania. Ale im więcej wolnej przestrzeni, tym różnice będą większe. Konkretnie można to sobie policzyć na poniższym kalkulatorze.
Warto zwrócić uwagę na to jak bardzo wraz z temperaturą zmienia się ciśnienie – różnice są tym większe im keg jest bardziej napełniony. Trzeba mieć to na względzie np. wynosząc keg w lecie do ogródka.
Ciśnienie wyszynku powinno być dostosowane do obecnie panującego w środku. Nalewając cydr z keg’a podłączamy do niego butlę i na bieżąco uzupełniamy gaz, żeby nie dopuścić do spadku ciśnienia – inaczej cydr w keg’u zacznie się nam wygazowywać.
Wydajność butli CO2
A ile się przy tym keg’owaniu zużywa gazu? Na ile starczy butla?
Moja mała butla mieści 1,5kg CO2. Jak ustaliliśmy: 1 mol CO2 waży 44g, czyli butla mieści ~34 mole CO2. Każdy mol ma objętość ~22,4L (w temperaturze 0C) – czyli butla będzie źródłem co najmniej 760L gazu.
Zakładając naprawdę solidne nagazowanie, na poziomie 5 vol CO2, w ~19L płynu rozpuści się 95L gazu, z czego 22L już tam będą z racji wstępnego nasycenia w fermentorze (1,15 vol CO2). Opróżniając keg, sukcesywnie będziemy zastępować płyn gazem. Jeśli założymy że operujemy w temperaturze 10C, czyli ustawiliśmy ciśnienie 3,4 atm (bezwzględne 4,4 atm), to na „wypchnięcie” całej zawartości będziemy potrzebować kolejne (pV=nRT) 80L gazu.
Czyli na całą operację nagazowania i opróżnienia keg’a zużyjemy ~153L gazu – tak więc jedna mała butla starczy na rzędu 5 takich kegów.
Ilość zużytego gazu znacząco rośnie wraz ze wzrostem temperatury serwowania, z racji tego, że uzupełniamy wolną przestrzeń gazem o większym ciśnieniu.
Refermentacja
Sztuczne gazowanie ma tą niezaprzeczalną zaletę, że pozwala osiągnąć efekt w dość krótkim czasie i dodatkowo nie powoduje powstawania osadu. Ale z drugiej strony bąbelki powstałe w wyniku sztucznego nagazowania są inne niż te z refermentacji: są większe, nie układają się w takie ładne sznury, i mam wrażenie że na krócej „starczają”.
Refermentacja, podobnie jak sztuczne gazowanie, polega na wprowadzeniu do pojemnika pewnej ilości CO2, który docelowo rozpuści się w płynie. Różnica polega na tym, że nie wprowadzamy tego gazu z zewnątrz, tylko powstaje on wewnątrz pojemnika, jako produkt uboczny pracy drożdży, pobudzonych do działania pojawieniem się nowej dawki cukru.
Jak już kiedyś pisałem, efektem przefermentowania 100g cukru jest m.in. powstanie około 47g dwutlenku węgla.
„Około”, bo dokładna ilość zależy od konkretnego szczepu drożdży, jak również od „czystości” samego cukru, czyli zawartości cukrów fermentowalnych. Cukier trzcinowy, czy taki zwykły biały z buraków, są w pełni fermentowalne. W pełni fermentowalna jest również glukoza, choć ta ma o rzędu 5% mniejszą „sprawność” jeśli chodzi o produkcję CO2. Z drugiej strony glukoza fermentuje łatwiej, bo jest cukrem prostym, co powinno przełożyć się na szybsze zakończenie refermentacji.
Określenie poziomu nasycenia jakie powstanie w wyniku refermentacji nie jest skomplikowane: sprowadza się do policzenia sumarycznej ilości dwutlenku węgla obecnej w pojemniku, określenia ciśnienia równowagi, i wyznaczenia na tej podstawie ilości rozpuszczonego CO2.
Na sumaryczną ilość dwutlenku węgla, oprócz tego który wyprodukują drożdże, składa się również CO2 którym już na wstępie nasycony jest cydr po fermentacji i leżakowaniu w zamkniętym fermentorze, oraz CO2 obecny w pozostawionej w pojemniku wolnej przestrzeni.
O ile w szyjce butelki pozostaje zwykle ~10-15ml pustego miejsca, i dodatkowo zamiast CO2 mamy tam powietrze, o tyle jeśli refermentacja prowadzona jest w keg’u, będzie tam praktycznie czysty CO2, na dodatek pod nieco większym niż atmosferyczne ciśnieniem. Również, prawdopodobnie, wolnego miejsca pozostawimy procentowo więcej niż w przypadku butelki. Oba te „dodatkowe” źródła CO2 (lub ich brak) mają istotne znaczenie dla efektu końcowego.
Nota bene, to właśnie ze względu na początkowe wypełnienie wolnej objętości dwutlenkiem węgla, napoje refermentowane w keg’ach są nieco bardziej nagazowane, przy tej samej ilości cukru.
Ciśnienie równowagi dla CO2 oblicza się rozwiązując układ równań:
nCO2 rozpuszczone = H * prównowagi * Vcieczy
prównowagi * Vwolnej przestrzeni = nCO2 w wolnej przestrzeni * R * T
nCO2 w sumie = nCO2 rozpuszczone + nCO2 w wolnej przestrzeni
stąd
prównowagi = nCO2 w sumie / (Vcieczy * H + Vwolnej przestrzeni / R / T)
Następnie obliczając i podstawiając wynik do pierwszego równania dostajemy ilość rozpuszczonego CO2.
Na koniec możemy policzyć całkowite ciśnienie panujące w pojemniku. Jeśli butelkowaliśmy napowietrzony cydr – to znaczy taki, z którego uleciał pozostały po fermentacji CO2 a w zamian rozpuściło się trochę tlenu i azotu , i/lub pozostawiliśmy w szyjce powietrze – w ciśnieniu całkowitym, oprócz ciśnienia CO2, musimy uwzględnić cząstkowe ciśnienia pozostałych gazów, które wbrew pozorom nie są zaniedbywalne.
Poniżej zrobiłem kalkulator, z pomocą którego można zobaczyć jaki efekt osiągniemy dodając do butelki (lub keg’a) daną ilość cukru.
Początkowa temperatura i ciśnienie atmosferyczne, które są jednymi z danych wejściowych, są potrzebne m.in. do obliczenia wstępnego nasycenia cydru dwutlenkiem węgla, jak również do określenia wstępnej ilości CO2 w wolnej objętości. Jako że ma to duże znaczenie, można również wybrać czy cydr jest wstępnie nasycony CO2, czy nie.
Ciśnienie względne zaraz po zamknięciu zostało uwzględnione na potrzeby keg’owania, jako że może być konieczne żeby uszczelnić wieko – chodzi tu o jednorazowe podanie pewnej ilości CO2, a nie o podłączenie butli z regulatorem na stałe, bo to nie ma sensu.
Temperatura końcowa to temperatura w której planujemy nasz nagazowany cydr serwować – pozwala sprawdzić jakie wtedy będzie nagazowanie, no i jakie ciśnienie będzie panować w butelce (względem ciśnienia podczas butelkowania).
Ta ostatnia informacja jest bardzo przydatna, żeby nie przesadzić z gazowaniem i nie dopuścić do eksplozji butelki. Sporo zależy od ilości szkła użytego do wykonania butelki, ale przyjmuje się że butelki „od piwa” można z powodzeniem używać do butelkowania cydrów pół-musujących, natomiast do musujących bezpieczniej stosować butelki od szampana, a i tu nie należy przekraczać 5,5 vol CO2, czyli ~20g/L cukru.
Rezultaty zdają się być poprawne. Przykładowo: zabutelkowałem kranówę o temp ~14C, w butelkach 0,75, z dodatkiem 20g/L cukru w każdej – efekt, w temperaturze ~22C, jest zbieżny z „teorią”:
Zdjecie 1 – Woda przefermentowana z dodatkiem 20g cukru na litr
Różnice biorą się stąd, że zamykając korek już na wstępie tworzy się w butelce pewne ciśnienie, nawet rzędu kilku dziesiątych atmosfery – jakie konkretnie, zależy od tego jak akurat dany korek się wepchnął.
Swoją drogą tak wygląda otwieranie takiej butelki w temperaturze pokojowej:
Film 1 – Cukier 20g/L, temperatura 22C
oraz po schłodzeniu do ~10C (jak widać wcale nie tak łatwo wyjąć korek, mimo wciąż wysokiego ciśnienia w środku):
Film 2 – Cukier 20g/L, temperatura 10C
Wpływ ciśnienia atmosferycznego
W kalkulatorze nie uwzględniam ciśnienia atmosferycznego podczas otwierania nagazowanego cydru, jako że nie ma ono bezpośredniego przełożenia na powstały w butelce poziom nagazowania czy ciśnienie bezwzględne – a jedynie na wskazanie ewentualnego manometru.
Natomiast natknąłem się na ciekawą obserwację, że ciśnienie atmosferyczne ma wpływ na prędkość uciekania bąbelków z butelki, czyli na percepcję poziomu nagazowania i ewentualne pienienie. Otóż cydry robione w rejonach górskich (np. 3000m n.p.m.), które otwierane na macierzystej wysokości są musujące, otwierane na poziomie morza, gdzie ciśnienie jest wyższe o kilkaset hPa (~1hPa/8m), zachowują się jak półmusujące!
Nie widzę jak to można wyprowadzić z praw gazowych, ale jako że pisali o tym goście, którzy robią cydry w takich warunkach, nie pozostaje mi nic innego jak przyjąć na wiarę 😉
Natomiast jestem zdania, że w typowym dla nas zakresie ciśnień 970–1030 hPa, wpływ ciśnienia atmosferycznego, zarówno podczas butelkowania, jak i tym bardziej przy otwieraniu butelki, jest zaniedbywalny.
Precyzja
Na zakończenie jeszcze kilka słów o dokładności obliczeń. Model użyty do obliczeń nie jest doskonały: nie uwzględnia rozszerzania się cieczy (np. nie pokazuje że butelka strzeli jak wypełni się ją po brzegi), ciśnienia par, a i pewnie jeszcze szeregu innych szczegółów, które nawet nie przyszły mi do głowy.
Rozszerzalność gazów liczona jest jak dla gazu doskonałego, podczas gdy gazy rzeczywiste zachowują się minimalnie inaczej – swoją drogą off-topic: co za bzdura z tym pompowaniem opon w samochodach azotem, że rzekomo nie zmienia objętości pod wpływem temperatury – zmienia, i to nawet bardziej niż powietrze! 😉
Prawo Henry’ego, które tak nam się tutaj przydaje, zostało użyte jak dla czystej wody, podczas gdy rozpuszczalność CO2 w mieszaninie wody z alkoholem jest większa niż w czystej wodzie. Choć tu na szczęście różnice są niewielkie i uwydatniają się dopiero przy wyższych temperaturach (np. 25C) i zawartościach alkoholu (np. 10%).
Rozpuszczalność zależy również od pozostałego w cydrze cukru resztkowego – CO2 rozpuszcza się w cieczy, a nie w cukrze – stąd im bardziej słodki cydr, tym mniej nasyci się gazem.
Ale myślę że na nasze potrzeby dokładność jest wystarczająca – i tak w praktyce nalejemy „prawie do pełna”, a cukru sypniemy „na oko” 😉
No, to chyba tyle. Miłego gazowania!


Jeśli takie nagazowanie osiągnęłaś już po kilku dniach to podejrzewam, że butelkowałaś bardzo młody cydr, tuż po, lub wręcz jeszcze w trakcie fermentacji? To jest typowe, że mętne cydry, wciąż z dużą ilością drożdży oraz drobinami owoców bardzo silnie się pienią – każda drobina tworzy centrum nukleacji, w którym tworzy się bąbelek. Jak się sklaruje to powinno być lepiej. Pytanie tylko czy nie za wcześnie butelkowałaś i ile dodałaś cukru, żeby butelki wytrzymały. Załóż wątek na forum i napisz coś więcej.
Kilka dni po dodaniu cukru otworzyłam butelkę i cisnienie wywaliło mi pół zawartosci butelki. Jestem nowa w temacie i mam pytanie czy to mi się uspokoi?
W butelkach? Nalewasz na próbę wodę, do pełna, potem odlewasz do menzurki z podziałką, po 10ml, i patrzysz jak to wygląda w butelce. Popatrz np. na zdjęcie 1 tutaj: https://projektcydr.pl/blog/?p=2039
Jak szacujesz/obliczasz niezapełnioną objętość?
Nie dodawaj cukru bezpośrednio: odlej sobie 0,5-1L do jakiegoś naczynia, tam dodaj cały cukier i porządnie wymieszaj aż się rozpuści – tak posłodzony płyn dolej do fermentora i jeszcze trochę spokojnie pomieszaj.
Zawsze przed rozlewaniem przelewam do drugiego fermentora, aby cydr był jednolity i rozlewam przez kranik. Do tej pory nie słodziłem w fermentorze z obawy, że nierównomiernie się cukier wymiesza. Jeśli w ten sposób masz dobre wyniki to chyba spróbuję następnym razem.
Zdarza mi się również dosładzać do każdej butelki z osobna, wygodny jest przy tym lejek – ale nigdy potem nie mieszam! Zobacz na zdjęciu 14 tutaj: https://projektcydr.pl/blog/?p=336, ile tam cukru zalega na dnie (15g na butelkę) – z czasem wszystko się samo rozpuściło. Ale jeśli mam wolny fermentor to zwykle przelewam do niego, żeby pozbyć się osadu z głównego fermentora, wtedy dodaję cukier, porządnie mieszam, i rozlewam przez kranik. Dzięki temu w każdej butelce jest taka sama ilość cukru, jak również jeśli cydr w fermentorze nie jest do końca jednolity, np. klarowny na górze a bardziej mętny na dole, wymieszanie pozwala uzyskać taki sam efekt w każdej butelce. Ewentualnie można przelać zawartość np. do kilku garnków, umyć fermentor, przelać z powrotem, i dopiero wtedy dosładzać – raz tak zrobiłem, potem mi się już nie chciało..
Cukier na gazunek i słodzik na smak dodajesz do każdej butelki indywidualnie, czy mieszasz w głównym zbiorniku i rozlewasz już doprawiony cydr? Ja dodaję do każdej butelki indywidualnie, ale przy ponad 40 butelkach jest strasznie dużo roboty, zwłaszcza z potrząsaniem butelkami, aby cukry się rozpuściły.
No było z tym trochę problemu – takie 6 atm to jednak bardzo duże ciśnienie. Wywierciłem otwór o średnicy trochę mniejszej niż gwint manometru, ale że to plastik to nie było potem problemu z wkręceniem. Kupiłem w Castoramie klej konstrukcyjny, taki który zwiększa objętość tężejąc, tubka 20ml, i posmarowałem gwint przed wkręceniem. A jak już stwardniało to dałem jeszcze od wewnątrz silikon.
Jak zostało uszczelnione miejsce montażu manometru z korkiem?