Typowa początkowa dawka drożdży do fermentacji cydru to 10g/100L. Jest tak dobrana, żeby drożdży było wystarczająco dużo, aby mogły sprawnie zdominować inne mikroorganizmy, ale jednocześnie żeby nie było ich zbyt dużo, bo „przedawkowanie” może pociągnąć za sobą wady i problemy podczas fermentacji.
Taka dawka przekłada się na około 1-2 miliony komórek drożdży w 1 mL.
Milion komórek drożdży w 1 mL to oczywiście dopiero początek. Drożdże szybko się mnożą i ich populacja w sprzyjających warunkach potrafi przekroczyć 100 milionów komórek w 1 mL. Z czasem oczywiście ta liczba maleje i drożdże opadają na dno.
Jeśli cydr ma być refermentowany, trzeba go zabutelkować gdy w nastawie wciąż znajdują się żywe drożdże, zdolne do skonsumowania dodanego cukru. Zawartość drożdży na poziomie 1 miliona komórek w 1 mL zapewnia szybką i sprawną refermentację, ale jednocześnie wiąże się z powstaniem w butelce dość dużego osadu. Dlatego z butelkowaniem lepiej poczekać aż cydr się nieco bardziej sklaruje i zawartość drożdży spadnie do ~250 tysięcy komórek w 1 mL. Refermentacja potrwa nieco dłużej, ale osad będzie zdecydowanie mniejszy. W przypadku butelkowania bardzo klarownego cydru, który uprzednio dojrzewał w zbiorniku przez wiele miesięcy, do uzupełnienia zawartości drożdży stosuje się dawkę 1g/100L.
Podobno profesjonalni producenci, którzy operują dużymi partiami i chcą mieć pełną kontrolę nad przebiegiem fermentacji, faktycznie liczą drożdże i podejmują na tej podstawie różne działania. Robią to po to, żeby uniknąć problemów, zapewnić jak największą powtarzalność partii, itd. Na mniejszą skalę raczej się tego nie praktykuje – do wyznaczania dawki inokulacji z powodzeniem wystarcza waga, a moment butelkowania wyznacza się uznaniowo, albo się go w ogóle nie wyznacza tylko butelkuje się wtedy kiedy ma się na to czas.
Ja zainteresowałem się tym tematem kiedy starałem się zrozumieć, w którym momencie powinienem zabutelkować mój francuski cydr. Znalazłem kilka wskazówek: 1) przez nalany do butelki cydr powinno się dać czytać nagłówki w gazecie (ale nie mały druk); 2) spadek gęstości powinien być rzędu 1g/L na 3 tygodnie (w 10C); 3) liczba komórek drożdży w 1 mL powinna wynosić ~250.000.
Załóżmy że chciałbym zastosować się do rady #3 i faktycznie policzyć te drożdże – to jak to się właściwie robi!?
Liczenie drożdży
Do liczenia drożdży potrzebny jest mikroskop oraz specjalna płytka.
Mikroskop powinien mieć powiększenie x400 (okular 10 x obiektyw 40). Wygodnie, jeśli jest wyposażony w kamerkę – nawet taka najprostsza (~1MP) jest w zupełności wystarczająca. Dzięki temu można wygodnie liczyć drożdże na ekranie komputera, a nawet skreślać sobie te, które już są policzone.
Mikroskop jak mikroskop. Najważniejsza jest specjalna płytka. Płytka ma wygrawerowaną szczegółową mikro-podziałkę, która ułatwia liczenie – ale co najważniejsze: ma precyzyjnie zdefiniowaną objętość badanej próbki, dzięki czemu wynik można przeliczyć na 1 mL.
Takie płytki są powszechnie używane w laboratoriach, do określania liczebności przeróżnych preparatów. Jest kilka różnych modeli – jednym z popularniejszych jest Neubauer Improved:
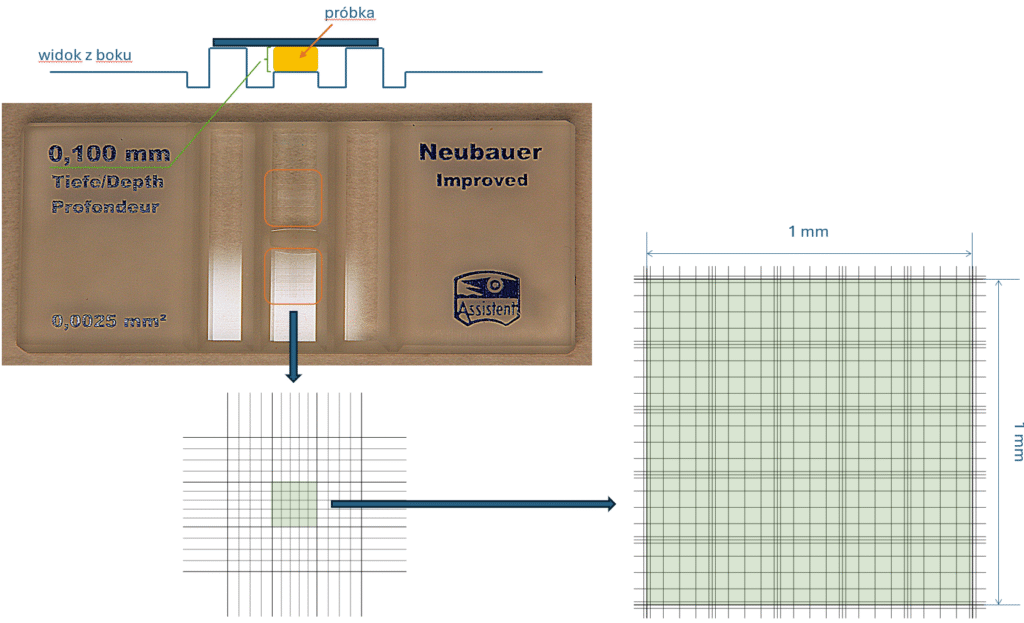
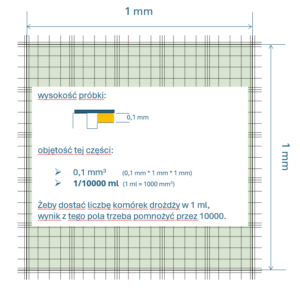
Na płytce są dwa niezależne pola, zakreślone powyżej na pomarańczowo, które służą do zliczania. Pola mają dokładnie ustalone wymiary, jak również ich wysokość jest ściśle określona.
Wielkości tych pól są sprytnie dobrane, tak żeby „pasowały” do różnych powiększeń mikroskopu:
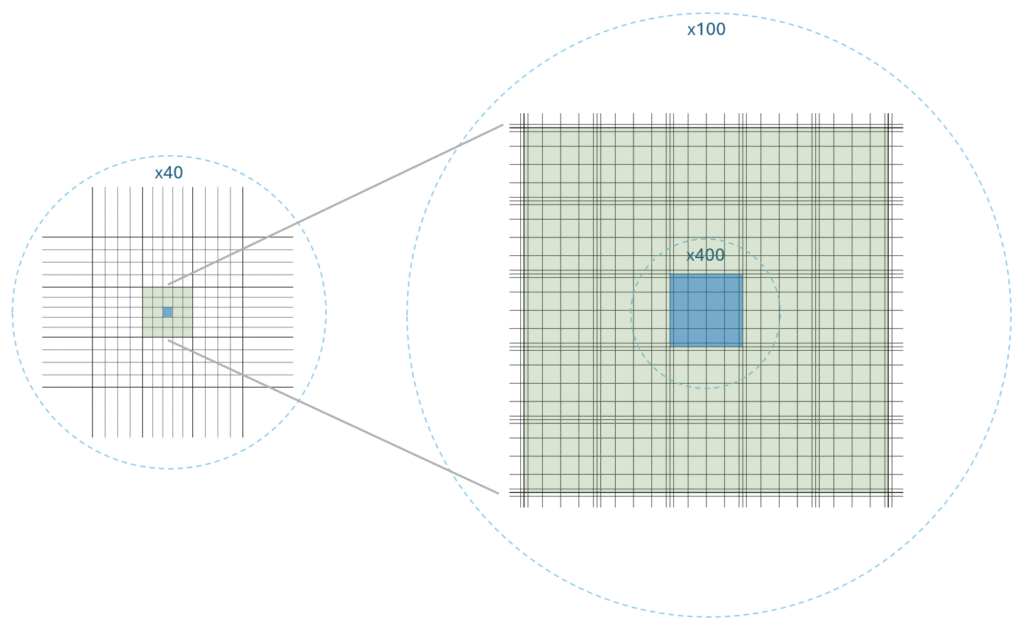
Drożdże zlicza się na środkowym polu, które powyżej zaznaczyłem na zielono. To pole składa się z 25 mniejszych pól (na niebiesko), które ogląda się używając powiększenia x400 i po kolei sumuje zauważone komórki. Potrójne linie służą łatwiejszej orientacji na obrazie.
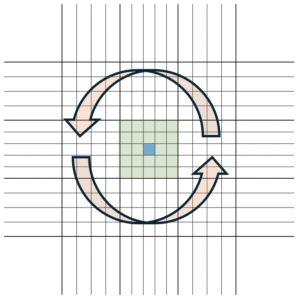
W przypadku gry drożdży jest niewiele, zliczenie drożdży z całego zielonego pola nie jest problematyczne i warto to zrobić, dla uzyskania precyzyjnego wyniku. Ale gdy drożdży jest dużo i ich liczenie jest czasochłonne, można ograniczyć się do kilku wybranych kwadratów, na przykład tych po przekątnej:
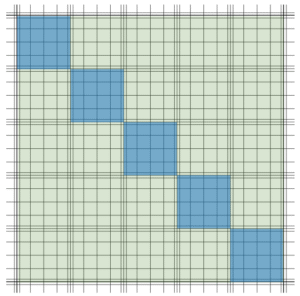
Liczbę drożdży na całym zielonym polu szacuje się w takim przypadku mnożąc otrzymany rezultat przez (25 / [liczba przeliczonych kwadratów]). Czyli w tym przypadku przez 5.
Objętość próbki znajdującej się na obszarze zielonego polu jest mikroskopijna, więc żeby przestawić wynik w przeliczeniu na 1 mL, liczbę zauważonych drożdży trzeba przemnożyć przez 10.000. Ten mnożnik bierze się stąd:
Tak wyglądają przykładowe „niebieskie” pola pod mikroskopem:
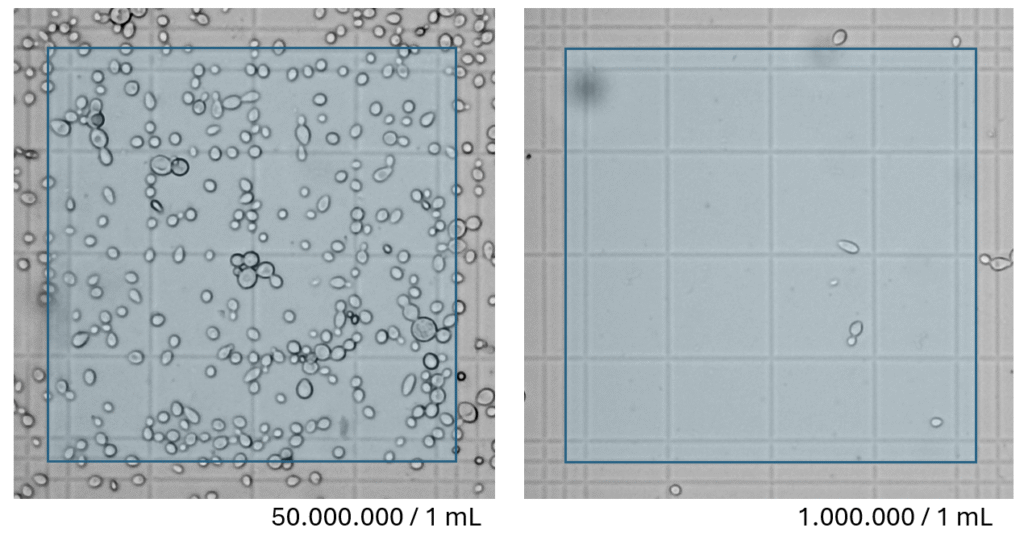
Jak widać przy 50 milionach komórek w mililitrze, na obrazie robi się już dość tłoczno. Żeby ułatwić sobie liczenie, można obraz trochę „rozgęścić”, rozcieńczając próbkę wodą destylowaną. Oczywiście rozcieńczanie trzeba zrobić na precyzyjnie odmierzonych objętościach, np. 10ml + 10ml, i dopiero po porządnym wymieszaniu pobrać i nałożyć preparat. Otrzymany wynik trzeba przemnożyć przez współczynnik rozcieńczenia: (objętość próbki po rozcieńczeniu) / (objętość przed rozcieńczeniem). Czyli w przypadku 1:1 przez 2.
Minimalna liczba drożdży, jaką można zmierzyć taką płytką, to 10.000 komórek / 1 mL. Odpowiada to znalezieniu dokładnie 1 sztuki drożdża na całym zielonym polu. W takim przypadku można rozejrzeć się jeszcze po pozostałych ośmiu sąsiadujących polach, żeby upewnić się czy i tam drożdży jest równie mało.
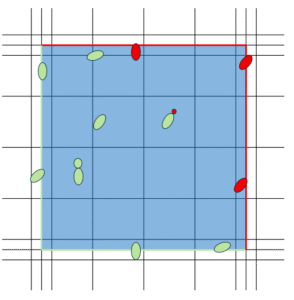
Niezależnie od ilości drożdży, zawsze prędzej czy później pojawia się pytanie: co zrobić z komórkami, które są akurat na granicy kwadratu, lub które właśnie pączkują. Żeby uniknąć „dubli”, warto przyjąć zasadę, że zlicza się tylko te drożdże które dotykają jednej pary sąsiadujących krawędzi, np. lewej i dolnej. A w przypadku „pączków”, tylko te, które są większe od połowy oryginału (oczywiście jest to pomiar „na oko”, więc dość subiektywny):
Nakładanie próbki
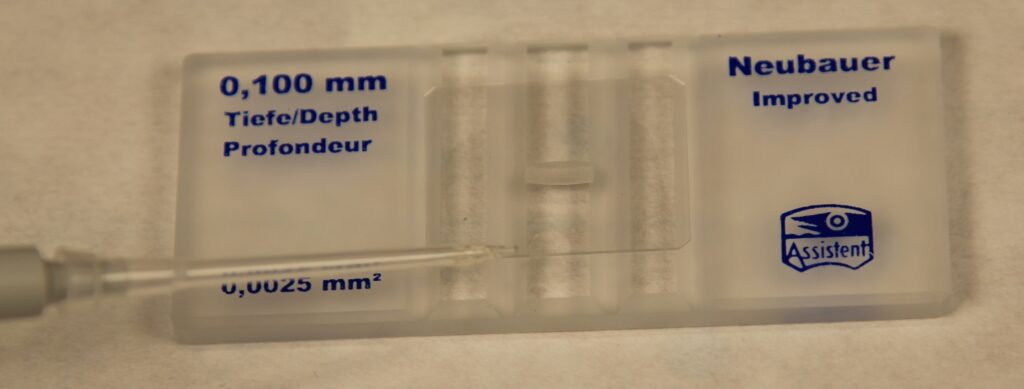
W komplecie z płytką jest specjalne szkiełko nakrywkowe, pod które wprowadza się próbkę. To szkiełko jest dużo grubsze niż takie zwykłe szkiełko. Zwykłe szkiełko mogłoby się wygiąć pod wpływem sił kapilarnych, co zaburzyłoby objętość próbki.
Ale nawet pomimo swojej grubości, to szkiełko jest zbyt lekkie, żeby własnym ciężarem odpowiednio docisnąć próbkę – więc przed nałożeniem próbki, trzeba je specjalnie „zamontować”. W tym celu zwilża się alkoholem te dwie powierzchnie znajdujące się po bokach pól pomiarowych, a następnie nasuwa się na nie szkiełko. Po wyschnięciu, jeśli szkiełko dobrze przylgnie, w miejscach podparcia tworzą się tęczowe wzory.


Próbkę nakłada się na sam koniec, zbliżając do brzegu szkiełka kropelkę próbki – z igły od strzykawki, lub z mikro-pipety. Próbka jest wciągana pod szkiełko siłami kapilarnymi. Próbkę trzeba podawać ostrożnie, uważając żeby nie „przelać”.
Oznaczanie martwych komórek
Komórki drożdży pracujące w nastawie po pewnym czasie obumierają. Normalnie pod mikroskopem nie widać różnicy pomiędzy żywymi i martwymi komórkami. Żeby je odróżnić, trzeba użyć barwnika. W tym celu używa się np. roztworu błękitu metylenowego. W podstawowej wersji jest to 0,5 g błękitu rozpuszczone w 100 mL wody destylowanej. Roztwór miesza się 1:1 z próbką i po kilku minutach nakłada preparat. Martwe drożdże barwią się na niebiesko, podczas gdy żywe pozostają przezroczyste.

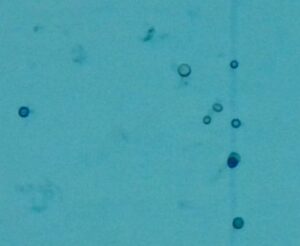
Moja obserwacja jest taka, że te komórki, które wciąż unoszą się w moich nastawach, są w zdecydowanej większości wciąż żywe – nieżywe opadają na dno. Żeby zrobić powyższe zdjęcie, obrazujące martwe komórki, musiałem pomieszać trochę nastawem i poderwać trochę drożdży z dna – bo bez tego nie mogłem znaleźć żadnego umarlaka. Więc wygląda na to, że na moje potrzeby, barwienie preparatu nie jest konieczne – mnie interesuje tylko liczba drożdży które wciąż unoszą się w cydrze, bo reszty i tak pozbędę się podczas zlewania.

Zajebiste, właśnie szukałem info co z moim cydrem bo 15h temu dodałem do 15 litrów soku z Jonagold porcję drożdży na 25 litrów i 1/3 pożywki na 30 litrów, i będę dodawał stopniowo z każdym dniem fermentacji, a na razie drożdże nie buzują, wyświetlił mi się ten blog i już wiem że 1-2 dni potrzebują, gratulacje ze twoje posty po 8 dniach realnie lądują w wyszukiwarkach, świetny wpis.